Alain Bouquet - Le noyau atomique
Attention: ces pages ne sont plus mises à jour car le site a déménagé. Il se trouve désormais à: Pensez à mettre à jour vos signets et bookmarks! |
Champs, Noyaux & particules
Radioactivité
Noyaux, protons et neutrons
- Noyau atomique: Rutherford
- Noyau atomique: Bohr, Soddy et Moseley
- Noyau atomique: Aston et Rutherford
- Neutron: Chadwick
- Neutron: Joliot-Curie
- Neutron: Fermi
Intruments, accélérateurs et détecteurs
Mécanique quantique
- Mécanique ondulatoire
- Formalisme quantique
- Applications
- Théorie quantique des champs
- Électrodynamique quantique
Fission nucléaire
Fusion nucléaire
Particules en tout genre
- La découverte du proton
- Francis Aston et la masse des noyaux
- Modèles de noyaux au temps de Rutherford
La découverte du proton
Éléments pour un modèle du noyau
- Le numéro atomique Z indique la charge positive +Ze du noyau [van den Broek 1911, Moseley 1914]
- La masse atomique A (en unités de la masse de l’hydrogène) est à peu près le double du numéro atomique Z
- Un même élément chimique peut exister sous formes d’isotopes dont la masse atomique A diffère [Soddy 1911]
- Radioactivité alpha → il y a des particules alpha (noyaux d’hélium) dans certains noyaux
- Radioactivité bêta → il y a des particules bêta (électrons) dans certains noyaux
Une idée de Rutherford : A ~ 2 Z
Dès 1911, Rutherford suggéra que tous les noyaux étaient peut-être des assemblages de ses chères particules alpha (A=4, Z=2). Mais beaucoup d’éléments s’écartent de ce modèle: la moitié des charges électriques Z sont impaires, les masses des éléments lourds sont bien plus grandes que le double de leur charge électrique… Peut-être un modèle mixte: héliums + autre chose ?

Une autre idée de Rutherford (et d’autres…) : tous les noyaux sont des assemblages de noyaux d’hydrogène (A=1, Z=1).
Alors un noyau de masse A est formé par A noyaux d’hydrogène. Mais cela donne une charge électrique +Ae et non +Ze. Il faut donc ajouter A-Z charges négatives, donc A-Z électrons dans le noyau. Ceci est cohérent avec l’émission d’électrons par les noyaux dans la radioactivité bêta ! Deux conséquences
- il devrait y avoir des noyaux d’hydrogène dans tous les noyaux
- il devrait exister un mécanisme séparant les Z électrons « périphériques » des A-Z électrons « nucléaires »
Découverte du proton
Tout commence par une nouvelle bizarrerie expérimentale. Avec Marsden, Rutherford bombardait en 1915 de l’hydrogène avec des particules alpha (avec du radon comme source) → observation de reculs de l’hydrogène, caractérisés par des traces plus fines que celles des alphas. Mais Marsden signala une émission d’hydrogène par le radon avant le remplissage de la chambre en hydrogène. Rutherford ne crut pas à une nouvelle forme de radioactivité, mais plutôt à une contamination de l’appareillage par l’hydrogène. Il nota en 1917-1918 que s’il remplissait la chambre d’oxygène ou de gaz carbonique, le nombre de scintillations attribuables à l’hydrogène diminuait, comme il s’y attendait.
Mais il augmentait quand la chambre était remplie d’air et plus encore d’azote.

Appareillage de Rutherford conduisant au proton
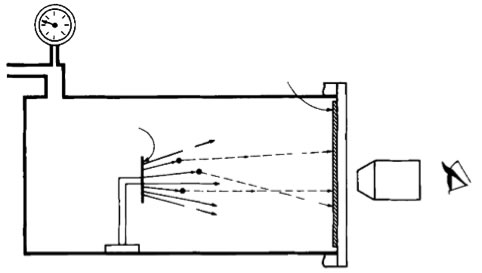
Schéma de l'appareillage: la chambre est remplie d'azote, une source d'alphas (la plaque sur le pied) les projette sur les noyaux d'azote et éjecte des protons qui provoquent des scintillations sur l'écran de sulfure de zinc à droite, observé au microscope.
Le phénomène n'apparaissait que pour des alphas d'énergie > 1.21 MeV. La première hypothèse reposait sur l'ionisation des molécules d’eau présentes. Mais le phénomène persista après suppression de l’eau, ce qui suggéra à Rutherford que l’azote se transmutait au cours de la collision avec les alphas, et que les protons appartenaient au noyau d’azote. Notons qu'à cette époque, on n’imaginait pas que des particules puissent être créées dans la collision, elles devaient nécessairement être présentes avant la collision et libérées par elle.
En fait, Rutherford pensait avoir observé la réaction alpha + azote -> hydrogène + carbone + alpha, et son interprétation fut la suivante en 1919 :
- Carbone: masse atomique 12 = 3 alphas
- Oxygène: masse atomique 16 = 4 alphas
- Mais azote: masse atomique 14 = 3 alphas + 2 hydrogènes périphériques, facilement arrachables
« We must conclude that the nitrogen atom is disintegrated under the intense force developed in a close collision with a swift alpha particle, and that the hydrogen atom which is liberated formed a constituent part of the nitrogen nucleus. » E. Rutherford, "Collision of alpha particles with light atoms. IV. An anomalous effect in nitrogen", Philosophical Magazine June 1919
Ceci avait deux conséquences majeures :
- les transmutations nucléaires ne sont pas limitées aux éléments lourds radioactifs.
- les collisions d’alphas permettent de sonder en profondeur les noyaux, pas seulement le cortège des électrons.
Une nouvelle technique de recherche s’ouvrait, mais limitée par la faible énergie des alphas d’où le développement des accélérateurs.


Du premier cyclotron de Lawrence à une (très petite) partie du LHC

Le laboratoire de physique du Cavendish en 1920
En 1919, Rutherford succéda à Thomson comme directeur du laboratoire Cavendish à Cambridge. Il emmena une partie de son équipe avec lui (en particulier Chadwick) et il trouva sur place de nouveaux collaborateurs de premier plan. L'utilisation de la chambre de Wilson (ou chambre à brouillard) se révéla bien plus pratique car elle permettait de visualiser, et d'enregistrer, le résultat des collisions sous la forme de traces des particules avant et après collision, et même parfois de mesurer leur charge et leur énergie. En 1920, Chadwick mesura la charge des noyaux Cu, Ag, Pt par diffusion alphas.

Des particules alpha, provenant d’une source sur la gauche, laissent une traînée de gouttelettes dans une chambre à brouillard remplie d’azote. L’une frappe un noyau d’azote en haut à droite, donnant un proton partant vers la gauche et un noyau d’oxygène partant en bas à droite. (Blackett 1925) 1920
Il y a bien des noyaux d’hydrogène dans le noyau d’azote. En 1920, Rutherford les baptise proton (du grec πρῶτον premier, élémentaire). Les expériences de Rutherford valident - apparemment - l’image du noyau comme un assemblage de A protons avec A-Z électrons « nucléaires », associés de préférence en sous-structures alpha. De nombreux modèles qualitatifs sont élaborés pour rendre compte des régularités empiriques, mais ils sont peu prédictifs, et très vite en conflit avec la nouvelle mécanique quantique.
- Inégalité de Heisenberg (1927)
Deux quantités complémentaires (p.e. position x et impulsion p) ne peuvent pas être mesurées simultanément. Cela entraîne une inégalité sur la dispersion des mesures de x et de p: Δx . Δp > ½ ħ. Un électron « enfermé » dans un noyau de taille 10-14 m devrait de ce fait posséder une énergie supérieure à 100 MeV alors que les bêtas ont rarement plus de 1 ou 2 MeV.
- Moments angulaires
Les moments angulaires sont quantifiés (en unités ħ ≡ h/2π). Les moments orbitaux sont des entiers, et le proton et l’électron ont un moment intrinsèque (spin) ±½ ħ [1927] Donc un nombre impair de protons et d’électrons a nécessairement un moment angulaire total (orbital + intrinsèque) demi-entier. Mais le noyau d’azote 14 a un moment angulaire total égal à 1 [Rasetti 1929], or il est censé être formé de 14 protons et 7 électrons.
Réactions nucléaires et transmutations artificielles
Francis Aston et la masse des noyaux
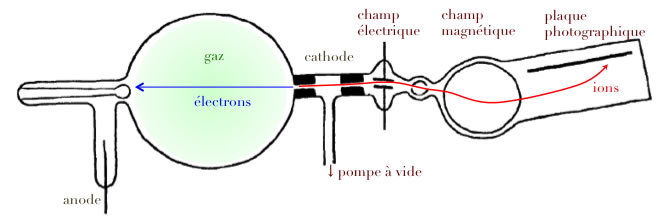
Spectromètre de masse

Francis Aston
- Assistant de J.J. Thomson au Cavendish
- Étude des « rayons canaux »
Soddy : isotopie pour les noyaux lourds radioactifs
Thomson et Aston :isotopie du néon 20 et du néon 22
Le spectromètre de masse
- champ électrique ⇒ déviation ~ e/m V
- champ magnétique ⇒ déviation ~ e/m V2
- mesure séparée des déviations ⇒ séparément e/m et V
- ou compenser l’influence de la vitesse sur une déviation électrique par son influence sur une déviation magnétique ⇒ tous les corps de même m/e aboutissent au même point
Principe :
Le spectrographe de masse d’Aston :
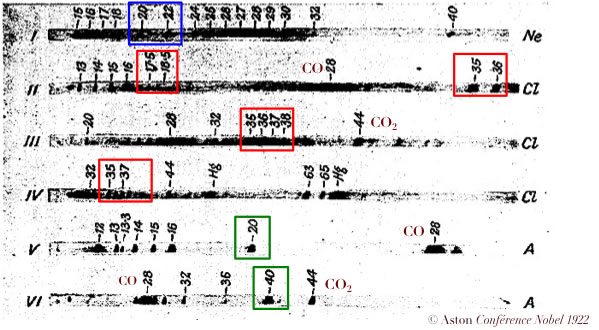
© Aston Conférence Nobel 1922
Par la suite, possibilité d’ions négatifs (par capture d’électrons)

Le (3°) spectrographe de masse d’Aston
Des isotopes (presque) partout
Exemples
- néon 20 et néon 22
- chlore 35 et chlore 37
Subtilités
HCl+ → lignes à 36 et 38
Cl++ → lignes à 17,5 et 18,5
Ar → lignes à 40 et à 20
Résultats essentiels
- Le nombre d’isotopes d’un élément est limité
- Les masses des isotopes sont tous des nombres entiers (à 1/1000 près)
- Les masses atomiques non-entières sont dues à la superposition de différents isotopes
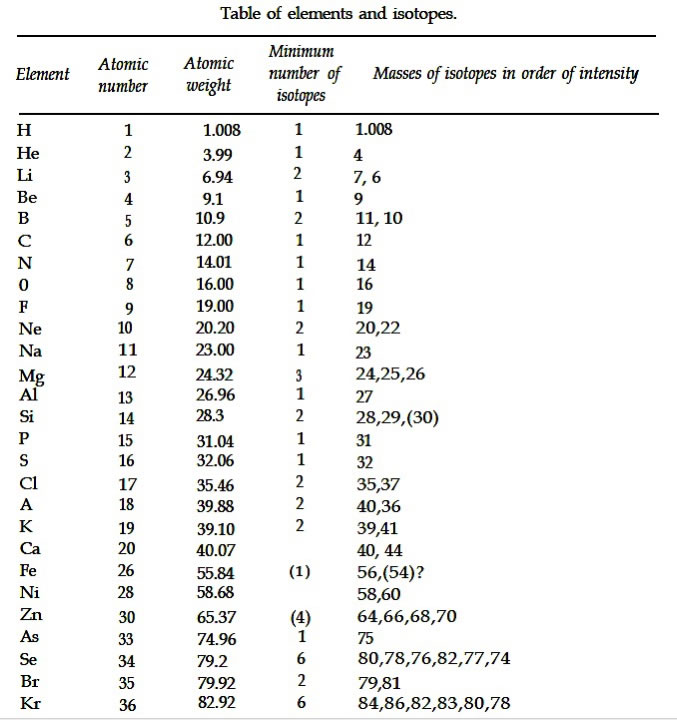
Table des isotopes

Progrès en spectrométrie de masse

Dempster 1918
Séparation isotopique
Défaut de masse et énergie de liaison
Les masses atomiques ne sont pas tout à fait des nombres entiers (que ce soient en unités de la masse de l'hydrogène, ou 1/12 de la masse du carbone 12, ou 1/16 de la masse de l'oxygène 16.
→ défaut de masse (énergie de liaison)
→ courbe d’Aston(1923)

À la seule exception de l’hydrogène, qui n'a bien sûr pas d'énergie de liaison ⇒ 4H → 4He + 7x1014 J/kg
Les modèles de noyaux de Rutherford
Un modèle de Rutherford pour les noyaux
En 1920 Il était généralement admis, malgré de graves contradictions, que les électrons, les particules alpha et les protons étaient des constituants majeurs des noyaux, dans la mesure où ces particules étaient émises par radioactivité pour les premières et par réaction nucléaire pour les dernières.
En 1920, Rutherford imaginait un atome comme un arrangement compact de A protons (de charge +1) et de A-Z électrons (de charge 1), formant un noyau de charge totale +Z, entouré au loin d’un nuage beaucoup plus diffus de Z électrons, responsables des propriétés chimiques de l’atome. Des regroupements de 4 protons et deux électrons (particules alpha) formaient apparemment des sous-assemblages dans le noyau. L’origine de la cohésion des noyaux n’était pas connue. La seule interaction alors connue (en dehors de la gravitation, qui est totalement négligeable à l’échelle atomique) était électrique, mais personne ne pouvait expliquer pourquoi A protons se collaient ensemble dans un noyau alors qu’ls auraient dû se repousser violemment du fait de leur charge électrique, ni pourquoi A-Z électrons se collaient étroitement aux protons tandis que les Z électrons restants se tenaient loin du noyau. Le noyau paraissait plus mystérieux encore que l’atome, empiriquement décrit par la théorie quantique de Bohr, qui n’avait d’aileurs encore aucune justification en 1920.
Les noyaux lourds (au-delà du plomb Z = 82) étaient instables et émettaient des particules alpha, des électrons (particules bêta) ou des photons de haute énergie (particules gamma). Ces émissions se faisaient de manière apparemment aléatoire, quoique suivant des lois statistiques : la probabilité par unité de temps de telle ou telle émission était constante pour un noyau donné, même s’il était impossible de prévoir quel noyau allait subir cette transmutation, et une corrélation avait été observée empiriquement entre l’énergie d’une particule alpha et la probabilité de son émission (loi de Geiger et Nuttall).
Au cours du phénomène de radioactivité, qui à cette époque ne concernait que les atomes les plus lourds, les noyaux éjectaient soit des noyaux d’hélium (radioactivité alpha) soit des électrons (radioactivité bêta). Il était donc logique de penser que les uns et les autres préexistaient à leur émission, et donc que les noyaux — au moins les noyaux lourds, radioactifs — étaient au moins en partie des assemblages d’alphas. Des électrons, de charge négative, devaient aussi être présents, et la charge apparente du noyau n’était que l’excès de charge positive. L’interaction de ces électrons « internes » paraissait bien différente de celle des électrons « externes » responsables des propriétés chimiques de l’atome, et cette différence était attribuée à une « déformation » de l’électron, selon l’expression de Rutherford dans sa Conférence Bakérienne de 1920, dans le champ électromagnétique très intense à très courte distance, l’électron n’étant pas nécessairement ponctuel.
Mais une particule alpha a une charge Z=2 et une masse A=4, et la majorité des noyaux ne pouvait donc pas être une simple association de noyaux d’hélium, leur charge n’était pas systématiquement paire ni leur masse multiple de 4, à commencer par le plus léger d’entre eux, l’hydrogène Z=1 et A=1. D’où l’idée que les noyaux étaient sans doute des assemblages d’électrons et de noyaux d’hydrogène. Les noyaux d’hélium, particulièrement stables, semblaient formés de quatre protons et deux électrons, et pouvaient former des sous-assemblages dans les noyaux lourds.
La présence de noyaux d’hydrogène dans les noyaux plus lourds semblait confirmée par les expériences de bombardement de l’azote par des particules alpha menées par Rutherford au cours de la première guerre mondiale et dont les résultats furent annoncés en 1919.
Protons satellites
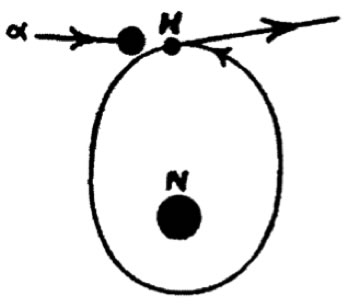
D’abord observé dans la diffusion d’alpha sur l’hydrogène (le noyau d’hydrogène étant mis en mouvement), puis lors de la diffusion d’alphas sur l’azote et l’oxygène. En bombardant de l’azote avec des particules alpha du polonium 214, Rutherford observa en 1919 l’éjection de particules allant plus loin que le sparticules alpha initiales. Rutherford et Chadwick les interprétèrent comme des noyaux d’hydrogène. Des résultats similaires durent obtenus avec la plupart des noyaux légers, du bore (Z=5, A=10 à 20% et 11 à 80%) au potassium (Z=19, A=39 à 93% et 41 à 7%).
C’était la première fois qu’il était démontré que des noyaux pouvaient être désintégrés par des collisions de particules. Rutherford en déduisit que l’ion hydrogène (le proton) était un des constituants du noyau d’azote (Z=7, A=14), qu’il imaginait plus ou moins comme un assemblage serré de trois alphas autour duquel orbitait un proton isolé (un proton satellite).

L’éjection d’un noyau d’hydrogène du noyau d’azote par collision d’un alpha, vu par Rutherford et Chadwick en 1921
Avec Chadwick, Rutherford consacra plusieurs années à tenter de mettre en évidence ces protons satellites du noyau, sans succès. Incidemment, la réaction était
42He + 147N → 11H + 178O
mais ce n’est pas ainsi que Rutherford l’interprétait : il pensait qu’après avoir éjecté le proton satellite, la particule alpha avait continué sa course en laissant derrière elle un noyau de carbone. Ce n’est que quelques années plus tard que Blackett répéta l’expérience avec une chambre de Wilson (ou chambre à brouillard) et qu’il découvrit que la particule alpha était capturée par le noyau d’azote lors de la collision.
En 1920, Rutherford imaginait un atome comme un arrangement compact de A protons (de charge +1) et de A-Z électrons (de charge 1), formant un noyau de charge totale +Z, entouré au loin d’un nuage beaucoup plus diffus de Z électrons, responsables des propriétés chimiques de l’atome. Des regroupements de 4 protons et deux électrons (particules alpha) formaient apparemment des sous-assemblages dans le noyau. L’origine de la cohésion des noyaux n’était pas connue. La seule interaction alors connue (en dehors de la gravitation, qui est totalement négligeable à l’échelle atomique) était électrique, mais personne ne pouvait expliquer pourquoi A protons se collaient ensemble dans un noyau alors qu’ls auraient dû se repousser violemment du fait de leur charge électrique, ni pourquoi A-Z électrons se collaient étroitement aux protons tandis que les Z électrons restants se tenaient loin du noyau. Le noyau paraissait plus mystérieux encore que l’atome, empiriquement décrit par la théorie quantique de Bohr, qui n’avait d’aileurs encore aucune justification en 1920.
Les noyaux lourds (au-delà du plomb Z = 82) étaient instables et émettaient des particules alpha, des électrons (particules bêta) ou des photons de haute énergie (particules gamma). Ces émissions se faisaient de manière apparemment aléatoire, quoique suivant des lois statistiques : la probabilité par unité de temps de telle ou telle émission était constante pour un noyau donné, même s’il était impossible de prévoir quel noyau allait subir cette transmutation, et une corrélation avait été observée empiriquement entre l’énergie d’une particule alpha et la probabilité de son émission (loi de Geiger et Nuttall).
Rutherford déduisait aussi de son modèle l’existence possible d’un isotope de l’hydrogène de masse 2 et de charge 1, formé de deux protons liés à un électron. Le deutérium fut découvert en 1931 par Harold Urey par distillation répétée de l’hydrogène liquide. Rutherford imagina aussi la possibilité qu’un électron soit lié à un seul proton, formant un noyau de masse 1 et de charge zéro, analogue à un atome d’hydrogène mais en beaucoup plus compact. Ce « neutron » fut recherché pendant 14 ans au Cavendish, en particulier par Chadwick. Rutherford pensa déduire aussi de ses expériences de diffusion d’alpha sur l’azote et l’oxygène la libération de noyaux de masse 3 et de charge 2, donc des noyaux d’hélium 3. En associant ces noyaux d’hélium 3 et d’hélium 4 avec des électrons en nombre adéquat, Rutherford imagina aussi la possibilité qu’il existe trois isotopes du lithium (Z=3) de masses 6, 7 et 8. Effectivement, le lithium naturel est à 92.5% du lithium 7 et à 7.5% du lithium 6 (le lithium 8 est très instable).
Rutherford commença en 1924 à étendre son modèle du noyau pour y inclure la radioactivité des noyaux lourds, mais la radioactivité alpha de l’uranium lui posait un problème. D’une part, les alphas produits par la disruption du noyau avaient une énergie de 4.3 MeV, et Rutherford calcula que, si cette énergie venait de la répulsion électrostatique, le point d’émission devait se trouver à 7x10-14 m du centre du noyau. D’autre part, ses propres expériences de diffusion avec Chadwick lui montraient que des alphas de 7.8 MeV (venant du polonium 214) étaient défléchis par un noyau d’uranium quand ils approchaient à 3x10-14 m, sans provoquer de disruption du noyau d’uranium. Rutherford étendit son modèle de protons satellites à des alphas satellites, et il modélisa en 1927 le noyau d’uranium comme un cœur compact entouré d’un nuage d’alphas satellites.
Taille des noyaux
Lors d’un bombardement d’atomes par des particules alpha, la plupart de celles-ci sont déviées par les noyaux, et cela d’autant plus fortement que ces noyaux sont lourds. La force de répulsion diminue comme le carré de la distance, et cette loi en 1/r2 correspond bien à une répulsion électromagnétique par une charge ponctuelle (ce qui signifie donc que les électrons de l’atome ne s’approchent pas aussi près du noyau). Cette loi demeure valide jusqu’à une distance de l’ordre de 3x10-14 m où elle commence à être violée : taille des noyaux et/ou force non-électromagnétique ?
Au terme d’une décennie d’expériences de diffusion des alphas sur des feuilles minces de différentes matières, Rutherford et ses collaborateurs concluent à la présence d’une force
- attractive
- plus intense que l’électromagnétique, et
- de très courte portée, devanant insensible au-delà de 10-14 m. Rutherford en conclut que cette valeur est la taille du rayon nucléaire.
Le rayon R d’un noyau est approximativement (un noyau a une surface diffuse) R = (1.25x10-15 m)A1/3. Le rayon des noyaux s’étage donc de 1.25x10-15 m pour l’hydrogène (A=1) à 7.74x10-15 m pour l’uranium (A=238).
Points à vérifier :
- Rutherford parle en 1911 de « concentration de charge » pas de noyau concentrant aussi la masse, quand cela devient-il clair pour tous ? N’est-ce pas implicite dans le modèle de Bohr de l’atome ? À l’époque, Bohr était à Manchester chez Rutherford, il a donc dû reprendre les idées de celui-ci. Ou a-t-il eu l’idée seul ? Mais le point est-il important si son modèle repose plus sur la distribution de charges électriques que des masses ?
- Y a-t-il eu un moment où les physiciens pensaient que chaque noyau était différent (92 objets différents) ? Dans ce cas, à quel moment ont-ils pensé qu’ils étaient composés de sous-ensembles ? Rôle des transmutations alpha (=il y a des alphas dans les noyaux radioactifs) et bêta (=il y a des électrons dans les noyaux radioactifs) dans ces réflexions ? Pensait-on que les noyaux radioactifs étaient différents des noyaux non-radioactifs (la majorité) ?
- Quand le noyau d’hydrogène est-il considéré comme un composant des autres noyaux ? Lors des expériences de Rutherford d’éjection de protons des noyaux d’azote par bombardement d’alphas ? o Si une particule éjectée est supposée présente avant la collision, cela conduit à un noyau « lourd » formé de protons, d’électrons et d’alphas ?
- Quand a-t-on cessé de supposer la pré-existence des particules éjectées dans les noyaux ? Après le modèle de Fermi de la transmutation bêta, en 1933, ou avant ?
Le "neutron" de Rutherford
Lors de la Conférence Bakérienne (depuis 1775, une des plus prestigieuses conférences devant la Royal Society à Londres) donnée le 3 juin 1920 avec pour sujet Nuclear Constitution of Atoms, Rutherford avait établi le bilan – et les perspectives – des bombardements de noyaux par des α. Évoquant le noyau d’azote (Z = 7), il estima qu’il devait être formé d’un cœur de 3 alphas, plus un proton isolé «satellite», celui qui, d’après lui, était éjecté dans une collision avec un alpha. La masse de l’azote étant 14, il ajouta un second proton satellite, mais la charge électrique aurait été trop élevée d’une unité, à moins de la compenser par un électron.
Rutherford en vint à émettre l’hypothèse d’une paire proton-électron très étroitement liée, une sorte de mini-atome d’hydrogène à l’intérieur du noyau. Cet objet, qu’il appelait « neutron » sur le modèle de « proton », aurait une masse analogue à celle du proton mais serait neutre, et permettait à Rutherford d’expliquer (qualitativement) la formation de tous les noyaux à partir de l’hydrogène malgré la répulsion électrostatique. Dans son idée, il n’était pas question d’une particule fondamentale.
« Sous certaines conditions [...], il serait possible qu'un électron se combine de façon beaucoup plus proche avec un noyau d'hydrogène, formant une sorte de doublet neutre. Un tel atome aurait des propriétés très originales. Son champ externe serait pratiquement zéro, sauf très près du noyau, et en conséquence il devrait être capable de se déplacer librement à travers la matière. Sa présence serait probablement difficile à détecter par spectroscope, et il pourrait être impossible de le confiner dans un récipient scellé. D'un autre côté, il devrait entrer facilement dans la structure des atomes, ou pourrait sinon s'unir avec le noyau ou être désintégré par un champ intense, résultant peut-être en l'échappement d'un atome d'hydrogène chargé ou d'un électron ou des deux »
1921 Interaction forte (Chadwick & Bieler) par intensité déviation rayons alpha sur N et O
Rutherford lança ses élèves, dont Chadwick, à la recherche de cet objet hypothétique (baptisé neutron dès 1921) sans aucun résultat pendant plusieurs années malgré beaucoup d’ingéniosité dans les méthodes de recherche. Ils ne parvinrent pas à découvrir de matériaux émettant naturellement ces « neutrons », et les méthodes de détection habituelles utilisant d’une manière ou d’une autre la charge électrique (ionisation, scintillation…) ne s’appliquaient pas à la recherche d’une particule neutre.
La possibilité d’un «diplon» (→ 2H) fut envisagée de même que celle d’un «triplon» (→ 3H)
Chadwick envisagea l’étude du béryllium par bombardement alpha: il ne donne pas de protons, mais peut-être donne-t-il des «neutrons»? L’idée fut développée par G. Gamow, W.D. Harkins et d’autres dans les années 1920, mais la découverte suivit un chemin inattendu, passant par deux expériences sans rapport avec cette recherche, et qui furent toutes les deux interprétées de manière erronnée !
- Octobre 1930: Walther Bothe bombarde du béryllium avec des rayons α de 5 MeV et il découvre un rayonnement neutre très pénétrant, qu’il interprète comme des γ (il pense en effet observer la réaction 42He + 94Be → 136C* → 136C + γ)
- Janvier 1932: Irène Curie et Frédéric Joliot montrent que le rayonnement de Bothe éjecte des protons d’un matériau hydrogéné comme la paraffine et l'interprétent comme un effet Compton ⇒ énergie du γ ~ 50 MeV ⇒ énergie non conservée
- Février 1932: James Chadwick montre qu’en réalité ce rayonnement est formé de particules neutres de masse voisine de celle du proton, et que la réaction est 42He + 94Be → 126C* + n
Harkins

Rutherford n’était pas le seul à jouer à ce genre de jeu de construction En 1915, William Draper Harkins (1873-1951) Harkins commença à s’intéresser à la structure des noyaux, en partant de l’observation que la plupart des éléments ont des masses qui sont à peu de choses près des multiples de la masse de l’hydrogène, et en attribuant l’écart à une conséquence de l’énergie de liaison (électromagnétique à l’époque). Harkins et son élève E.D. Wilson supposèrent même que la conversion d’hydrogène en hélium pouvait être la source d’énergie des étoiles. Harkins nota la forte décroissance de l’abondance d’un élément dans la croûte terrestre et dans les météorites avec la masse atomique.
Harkins remarqua surtout que les éléments contenant un nombre pair de protons et d’électrons (dans un modèle où les noyaux étaient formés de A protons et A-Z électrons) étaient plus abondants que ceux contenant un nombre impair de protons et un nombre pair d’électrons, eux-même plus abondants que ceux contenant un nombre pair de protons et impair d’électrons, ceux contenant un nombre impair aussi bien de protons que d’électrons étant les plus rares de tous. Il imagina aussi que certains des éléments légers parmi les plus abondants, comme le carbone 12, l’oxygène 16 ou le néon 20, pouvaient être formés de particules alpha (imaginées comme des associations particulièrement stables de 4 protons et 2 électrons).
En 1920, dans son article « The Nuclei of Atomes and the New Periodic System », il mentionna l’existence possible d’associations analogues de 2 protons et d’un électron (le deutéron découvert en 1931 par Harold Urey) ou d’un proton et un électron (le neutron). Cet article est cité par Rutherford dans sa Conférence bakérienne de 1920. Dans un article de 1921 (communiqué par Rutherford au Philosophical Magazine), Harkins introduisit le mot neutron pour « a term representing one negative electron and one hydrogen nucleus. » Le mot avait été utilisé auparavant (par W. Sutherland en 1899 et par W. Nernst en 1903) mais pour des concepts différents.