Alain Bouquet - Radioactivité: Rutherford
Attention: ces pages ne sont plus mises à jour car le site a déménagé. Il se trouve désormais à: Pensez à mettre à jour vos signets et bookmarks! |
Champs, Noyaux & particules
Radioactivité
Noyaux, protons et neutrons
- Noyau atomique: Rutherford
- Noyau atomique: Bohr, Soddy et Moseley
- Noyau atomique: Aston et Rutherford
- Neutron: Chadwick
- Neutron: Joliot-Curie
- Neutron: Fermi
Intruments, accélérateurs et détecteurs
Mécanique quantique
- Mécanique ondulatoire
- Formalisme quantique
- Applications
- Théorie quantique des champs
- Électrodynamique quantique
Fission nucléaire
Fusion nucléaire
Particules en tout genre
ERNEST RUTHERFORD (1871-1937)
« All science is either physics or stamp collecting »

Arrivée au Cavendish Laboratory à Cambridge, pour travailler sur le magnétisme et les ondes radio, Rutherford a littéralement créé la physique nucléaire au cours d'une carrière éblouissante:
- Au Cavendish Laboratory de Cambridge (1895-1898)
- Ionisation des gaz sous l’effet des rayonnements
- Radioactivités alpha et bêta
- À l’université MacGill de Montréal(1898-1907)
- Découverte du radon
- Découverte de la décroissance radioactive, avec Soddy puis Hahn
- Découverte des transmutations « atomiques »
- À l’université de Manchester (1907-1919)
- Identification des alphas avec des ions hélium
- Découverte du noyau, avec Geiger et Marsden
- Collisions nucléaires et découverte du proton, avec Chadwick
- À la direction du Cavendish Laboratory de Cambridge (1919-1937)
- Théorie des noyaux
- Dirige les recherches de Chadwick, Blackett, Cockroft, Walton, Kapitza …
- Prix Nobel de chimie 1908
Il passa trois ans au Cavendish, où il travailla sur les rayons X avec J. J. Thomson, avant d’obtenir en 1898 un poste de professeur à Montréal, à l’Université McGill. Il montre en 1899 l’existence de deux rayonnements différents émis par les corps radioactifs, qu’il appelle alpha et bêta selon leur pouvoir de pénétration. Il épousa Mary Newton en 1900. Il découvrit en 1902 avec Frederick Soddy que la radioactivité alpha et bêta changeait la nature chimique de l’atome émetteur, et ils estimèrent l’énergie produite dans cette «désintégration». Professeur à Manchester en 1907 (où il mit au point avec Hans Geiger l’ébauche du futur compteur Geiger-Müller), il établit avec Thomas Royd que les particules alpha sont bien des noyaux d’hélium. La même année, il reçut le prix Nobel de chimie, ce qui le déçut un peu car il se considérait avant tout comme un physicien. En 1911, il découvrit que l’atome est formé d’un noyau minuscule contenant la quasi-totalité de la masse, entouré d’un immense nuage d’électrons : une mouche dans une cathédrale selon une comparaison célèbre.

Pendant la Première Guerre Mondiale, pour lutter contre les sous-marins, il tenta de mettre au point un sonar (ce que Paul Langevin fit au même moment en France). En 1919, il revint à Cambridge prendre la direction du laboratoire Cavendish. Sous son impulsion, Chadwick y découvrit le neutron, Cockroft et Walton y mirent au point les premiers accélérateurs de particules, Appleton découvrit l’ionosphère. Il mourut brutalement en 1937, à la suite d’une opération apparemment banale. On pourrait presque dire que Rutherford a passé dix ans de sa vie à comprendre ce qu'était la radioactivité, puis les années suivantes à l'exploiter comme outil pour explorer la matière, et découvrir ainsi successivement le noyau, le proton, le neutron et les transmutations artificielles. Il mourut juste avant que la découverte de la fission ouvre la voie de l'énergie nucléaire qu'il avait pressentie, sans oser vraiment y croire.

L’entrée de l'ancien laboratoire Cavendish à Cambridge
Lord Cavendish avait financé en 1869 la création d'une chaire de physique expérimentale à l'université de Cambridge, confiée à Maxwell (bien qu'il fût plutôt un théoricien) qui donna sa leçon inaugurale en 1871. À sa suggestion, un laboratoire fut adjoint à la chaire et inauguré le 16 juin 1874. À la suite d ela mort prématurée de Maxwell, John William Strutt, lord Rayleigh (1842-1919), en prit la direction, puis la confia en 1884 à J. J. Thomson qui n'avait alors que 28 ans. Le laboratoire Cavendish devint l’un des plus importants laboratoires de physique expérimentale au monde. Rutherford succéda à Thomson en 1919. Vingt-neuf membres du Cavendish reçurent le prix Nobel de physique, de chimie ou de médecine.

La cour intérieure de l'ancien laboratoire Cavendish à Cambridge
Parmi les élèves et les collaborateurs de Rutherford:
- Frederick Soddy (Nobel 1921 chimie)
- Francis Aston (Nobel 1922 chimie)
- Niels Bohr (Nobel 1922 physique)
- Charles Wilson (Nobel 1927 physique)
- James Chadwick (Nobel 1935 physique)
- Otto Hahn (Nobel 1944 chimie)
- Edward Appleton (Nobel 1947 physique)
- Patrick Blackett (Nobel 1948 physique)
- Cecil Powell (Nobel 1950 physique)
- John Cockroft (Nobel 1951 physique)
- Ernest Walton (Nobel 1951 physique)
- Piotr Kapitza (Nobel 1978 physique)

Bas-relief à l’entrée de l’ancien Cavendish Laboratory de Cambridge en l’honneur de Lord Rutherford. L'origine du surnom de crocodile donné à Rutherford est controversée: la voix puissante de Rutherford annonçant son approche comme le tic-tac du crocodile de Peter Pan, le symbole ancien des alchimistes et Rutherford transmutait la matière, le fait que le crocodile ne se retourne jamais et est donc un symbole de persévérance, ou enfin la possibilité que ce soit le surnom que Kapitza lui aurait donné car le crocodile serait en argot russe (крокодил) le patron, mais Kapitza ne confirme pas cette origine, tout en disant qu'elle doit rester secrète.
Ernest Rutherford était le quatrième des douze enfants d’un fermier néo-zélandais (qui était aussi mécanicien et ingénieur) et d’une institutrice. Il reçut une éducation soignée, et se montra aussi un excellent joueur de rugby. Il obtint une bourse pour l’université de Christchurch où il fut diplômé en 1893 en mathématiques et physique. Il se lança dans des recherches personnelles sur la magnétisation du fer par les ondes hertziennes (~cohéreur de Branly) publiées dans les Transactions of the New Zealand Institute qui lui permit en 1895 d'obtenir une bourse de 3 ans lui permettant d’aller au Royaume-Uni. Son objectif était de déposer des brevets sur la radiotélégraphie afin de faire fortune pour se marier avec sa fiancée, Mary Newton.
Alphas et bêtas
"Ces expériences montrent que le rayonnement de l'uranium est complexe et qu'il comporte au moins deux types distincts de rayonnements – l'un qui est très facilement absorbé et que l'on appellera par commodité le rayonnement alpha, et l'autre de caractère plus pénétrant qui sera appelé le rayonnement bêta”
Au laboratoire Cavendish, Thomson et McClelland avaient en 1896 observé l'ionisation de l'air par les rayons X en utilisant une des toutes premières chambres d'ionisation. Deux plateaux séparés et soumis à une différence de potentiel: les rayons X arrachaient des électrons aux atomes qui devenaient des ions positifs, la différence de potentiel attirait les électrons d'un côté, les ions de l'autre (empêchant leur recombinaison) et un courant passait donc entre les plateaux.

Schéma de principe d'une chambre d'ionisation (Wikipedia)
Thomson et McClelland avaient conclu que l'ionisation de l'air ressemblait à une électrolyse, mais leurs résultats étaient seulement qualitatifs. Rutherford était arrivé au laboratoire Cavendish en novembre 1895 pour mener des expériences de transmission d'ondes hertziennes sur des distances de l'ordre du kilomètre, mais Thomson le chargea d'explorer quantitativement les effets d'ionisation des gaz par les rayons X de Röntgen. Cela occupa Rutherford pendant plus d'un an, avant qu'il se tourne vers les rayons de Becquerel en février 1898 et inverse ses priorités, utilisant désormais l’ionisation pour étudier la radioactivité.
Son montage initial était extrêmement simple: une chambre d’ionisation reliée à un électroscope à feuille d’or. Pour plus de précision, il remplaça rapidement l’électroscope par un électromètre à quadrants de Kelvin, beaucoup plus sensible et précis. Son montage était donc analogue à celui de Pierre Curie au même moment (mais sans balance à quartz). Les expériences de Rutherford furent toujours très simples, très ingénieuses et très minutieuses pour éliminer artefacts et varier facilement les paramètres (sources, absorbants, géométrie, environnement). Rutherford n'observa ni réfraction ni polarisation des rayons de Becquerel (à la différence de ce dernier, qui changea ensuite d'avis).

Puis Rutherford examina la manière dont les rayons de Becquerel étaient absorbés par différentes substances, en interposant un nombre croissant de feuilles métalliques (de 5 nm): le courant d’ionisation diminuait d’abord très vite quand le nombre de feuilles augmentait, puis il ne variait presque plus, même en augmentant le nombre de feuilles.

Rutherford effectua une étude systématique, en variant la composition et la disposition du sel d’uranium (en bloc, en poudre plus ou moins étalée…) et selon la nature des feuilles interposées : laiton (cuivre + zinc), aluminium, puis cuivre, argent, étain, platine et verre. Il finti par conclure le 1° septembre 1898 qu’il existait deux composantes dans le rayonnement de l’uranium:
- l’une fortement absorbée qu'il nomma composante alpha
- l’autre beaucoup moins absorbée, qu'il nomma composante bêta
Rutherford remarqua également que la composante alpha était d’autant plus facilement absorbée par une substance que celle-ci avait une masse atomique élevée: l' aluminium (27) absorbait moins que le cuivre (64) à épaisseur égale, lui-même moins que le zinc (65), que l'argent (108), que l'étain (119) et que le platine (195) De très faibles épaisseurs suffisaient: quelques centimètres d’air arrêtaient les rayons alpha. La composante bêta était absorbéeelle aussi, mais beaucoup plus difficilement: 100 fois moins pour l’aluminium par exemple.

Figure de l’article de Rutherford montrant la décroissance exponentielle du rayonnement avec l’épaisseur d’aluminium
Existe-t-il un lien entre pouvoir ionisant et facilité d’absorption?
Les rayons bêta se révélèrent assez vite être des électrons. En 1899, Becquerel d'une part et Giesel de l'autre parvinrent à dévier des rayons bêta par des champs électrique et magnétique et obtinrent ainsi une valeur du rapport masse/charge électrique voisine de celle obtenue par Thomson pour les rayons cathodiques. L'identification entre rayons bêta et électrons était très plausible, ce qui fut renforcé par les mesures plus précises de Kaufmann en 1907. Les vitesses étaient par contre bien plus élevées, proches de la vitesse de la lumière, ce qui voulait dire que les énergies étaient près de 1000 fois plus grandes (de l'ordre du MeV au lieu du keV pour les rayons cathodiques).
En 1900, Paul Villard observa un 3° type de rayonnement encore plus pénétrant que les bêta et impossible à dévier. Il pouvait donc s'agir soit d'une particule très lourde ou très rapide, ou d'une particule neutre. Rutherford lui donna en 1903 le nom de rayonnement gamma, pour continuer l'alphabet grec. Costa Andrades et Ruth montrèrent en 1914 que le rayonnement était un rayonnement électromagnétique de très courte longueur d'onde (< 1 pm = 10-12 m) en observant sa diffraction par des cristaux.
Identifier dans le rayonnement alpha des noyaux d'hélium se révéla plus difficile, et prit près de 10 ans à Rutherford. L'hélium avait été découvert en 1868 par l'astronome Norman Lockyer dans le spectre du Soleil, mais il ne fut identifié sur Terre qu'en 1895 par Ramsay, justement dans des minerais d'uranium. En 1903, Ramsay et Soddy observèrent la production d'hélium par le radium, et finalement en 1907-1908 Rutherford et Royds observèrent les raies caractéristiques de l'hélium en collectant des alpha. Entretemps, Rutherford était parvenu en 1903 à dévier des rayons alphas par un champ électrique intense, et à mesurer en 1905 leur rapport masse/charge électrique et à montrer qu'il avait la même valeur pour des alphas émis par du polonium et par du radium, et que cette valeur était compatible avec celle d'un ion d'hélium.

- Commenter article alpha-bêta
- Expérience analogue aux Curie (mais sans balance à quartz) avec laiton, aluminium, effet de surface (alpha) effet de profondeur (bêta), opacité croissante avec la masse atomique
- Même résultats alpha et bêta avec le thorium.
- Et les Curie trouvent la même chose avec le radium.
En fait, U238, Th234 et Ra226 sont de purs émetteurs alpha, mais il y a des bêtas dans la chaîne de désintégration (équilibre séculaire).

La chaîne de transmutations partant du thorium 232
Transmutations
L’université McGill de Montréal

Université anglophone de Montréal depuis 1821
Département (et chaire) de physique créés en 1891 par scission du département de mathématiques et sciences naturelles, grâce à un don du philanthrope (et magnat du tabac quoique non-fumeur) William MacDonald, puis création d’une seconde chaire en 1893, avec un laboratoire très bien équipé pour l’époque
Nomination de Rutherford comme professeur de physique à l’automne 1898. Inconvénient majeur: Montréal était très loin d’être un centre aussi en pointe que Cambridge! Avantages: un poste de titulaire bien payé (→ Rutherford épousa Mary Newton en 1900), un laboratoire moderne et Frederick Soddy.

Ernest Rutherford en 1905 à McGill
RADON
Moi j'ai dit bizarre? Comme c'est bizarre!
En 1898, quand il était encore au Cavendish à étudier la radioactivité de l'uranium et du thorium, Rutherford avait observé que la radioactivité de ce dernier "variait de la manière la plus capricieuse" alors que le rayonnement des composés d'uranium demeurait constante. Il avait cependant fini par remarquer que c'était les courants d'air dans le laboratoire qui perturbaient les mesures de radioactivité. En gardant fermée la chambre d'ionisation, il avait pu mener ses mesures à bien mais l'origine des perturbations l'intriguait.
Un fois installé à McGill , Rutherford revint donc à l'effet des courants d'air sur la radioactivité du thorium. En collaboration avec Robert Owens, il finit par démontrer que le thorium libérait continuellement des particules radioactives, ce qu'il baptisa une «émanation», probablement gazeuse. Cette émanation était elle aussi ionisante et sa présence ou son absence (quand le vent l'emportait) modifiait l'ionisation due au thorium lui-même (Rutherford, A radioactive substance emitted from thorium compounds. Phil. Mag., Ser. 5, 49:1-14:1900). L'émanation était électriquement neutre (→ ni alpha ni bêta). Pour l'étudier efficacement, il envoya de l'air sur du thorium et recuillit les gaz dans un flacon. Son contenu était ionisant, donc probablement radioactif lui-aussi. Il se rendit même compte que la radioactivité qu'il avait mesuré pour le thorium était en grand partie due en réalité à l'émanation.
[En fait il existe un grand nombre d'éléments radioactifs présents en même temps que le thorium, et tous contribuent à des degrés divers à la radioactivité "du thorium"].
Nature de l'émanation

Montage de Rutherford pour déterminer la nature de l’émanation (septembre 1899):
- Oxyde de thorium enveloppé dans du papier (laissant passer l’émanation mais pas le rayonnement α du thorium lui-même)
- L’émanation est aspirée par un tube dans une chambre d’ionisation, reliée à un électromètre à quadrants
- L’électromètre permet de mesurer la radioactivité de l’émanation
Procédure:
- Aspirer l’air jusqu’à stabilisation du courant d’ionisation
- Arrêter l’aspiration
- Mesurer le courant d’ionisation pendant une dizaine de minutes
- Recommencer
Le nombre de corps radioactifs découverts ne cessait de croître
- Uranium (Becquerel 1896)
- Thorium (Schmidt 1898)
- Polonium (Curie 1898)
- Radium (Curie 1898)
- Actinium (Debierne 1899)
- Émanation (Rutherford 1899)
La particularité la plus spectaculaire de l'émanation était que son activité diminuait rapidement: le courant d'ionisation mesurant l'activité de l'émanation diminuait de moitié chaque minute, alors que tous les autres corps radioactifs connus voyaient leur activité stable au cours du temps (ce qui était d'ailleurs une source majeurs d'interrogations pour les physiciens). Mais la répétition des mesures ne laissait aucune place au doute:
- t = 0 courant 100%
- t = 62 s courant 51%
- t = 118 s courant 23%
- t = 210 s courant 7%
- t = 360 s courant 2%

Une diminution de moitié de la radioactivité chaque minute se traduit mathématiquement par une décroissance exponentielle de la forme A(t) = A(0) exp{-t/τ) avec τ ~ 80 secondes [t½ = τln 2 =56s]. ☞ il parut invraisemblable que ce soit un nouvel élément : il serait instable ! Par définition quasiment, un élément chimique ne pouvait être ni créé ni détruit, il se conservait intact à travers toute réaction chimique, ne changeant que son association avec d'autres éléments.
Par toute une série d'astucieux montages, Rutherford vérifia que la décroissance de l’activité de l'émanation ne dépendait pas de la chimie du thorium, ni des conditions ambiantes (pression ou température), ni du voltage (il ne s’agissait donc pas d’une destruction de l’émanation par le champ électrique). Il vérifia également que l’émanation du thorium était bien un gaz, et non des poussières ou des "vapeurs" de thorium (sublimation?) en intercalant des obstacles mécaniques (une bourre de coton par exemple).
Rutherford modifia ensuite légèrement son montage pour aspirer toute l’émanation et mesurer l’augmentation de radioactivité au fur et à mesure qu’elle se reformait à partir du thorium. Les deux courbes étaient parfaitement symétriques. [Expliquer pourquoi?]

Quelle était la nature de l’émanation? Rutherford pensa avoir affaire à un gaz inerte, peut-être l'un de ceux que Ramsay isolait l'un après l'autre à cette époque: argon (1894), hélium (1895), néon (1898), krypton (1898), xénon (1898). En collaboration avec son étudiante Harriet Brooks (1876-1933), Rutherford pencha d'abord pour l'argon avant se convaincre qu'il avait affaire à un nouvel élément (The new gas from radium Trans. R. Soc. Can. 1901). Soddy et Ruth montrèrent en 1902, qu’il était bien chimiquement inerte en lui faisant traverser divers réactifs chimiques sans qu'il en soit affecté.
L'émanation du radium
L'article de Rutherford et Brooks portait sur l'émanation du radium, car entretemps le radium avait également manifesté une "émanation". Pierre et Marie Curie avaient eux aussi rencontré des instabilités de mesure en présence de courants d'air et ils avaient signalé une « radioactivité induite »: une substance placée à proximité du radium devenait elle aussi radioactive, l’air lui-même semblait devenir radioactif (Sur la radioactivité provoquée par les rayons de Becquerel Comptes Rendus Ac Sc, 129: 714-716:1899). En 1900, Friedrich Dorn avait vérifié les résultats de Rutherford avec le thorium confirmé la présence similaire d’une émanation radioactive avec le radium, mais pas avec l’uranium ni le polonium (Über die von radioaktiven Substanzen ausgesandte Emanation, Sur l'émanation émise par les substances radioactives). En 1903, André Debierne signala que l'actinium lui aussi libérait une émanation radioactive.
Vérifier la chronologie en partant des articles originaux: selon les sources, on a Rutherford → Dorn, ou Curie → Dorn→ Rutherford, voire Dorn→Curie
Les Curie pensaient en 1903 que cette émanation résultait d'une «activation» d’un élément connu par l’énergie rayonnée, mais la majorité des physiciens penchait pour un nouvel élément. Rutherford soutint en 1904 que les émanations du thorium, du radium et de l'actnium différaient grandement par leur demi-vie, et qu'il devait donc s'agir d'éléments distincts:
- t½ = 3.8 jours pour l'émanation du radium
- t½ = 56 s pour celle du thorium
- t½ = 4 s pour celle de l'actinium
Ces trois éléments reçurent alors les noms de exradio, exthorio, et exactinio en 1904. En 1910, Ramsay proposa le nouveau nom de niton (le brillant) pour l'émanation du radium, la terminaison en -on, celle des gaz inertes, étant justifiée car Ramsay avait montré en 1904 que les trois émanations présentaient des spectres analogues à ceux de l'argon, du krypton et du xénon, suggérant qu'il appartenaient bien à la famille des gaz inertes comme Rutherford l'avait pensé. En 1918, ls trois émanations furent rebaptisées radon, thoron, et akton. lLs noms devinrent radeon, thoreon, et actineon en 1919 avant de redevenir en 1920 radon, thoron, et acton (à nouveau modifié en actineon en 1923). Aujourd'hui, on les appelle radon 222, radon 220 et radon 219, selon l'habitude de baptiser les différents isotopes d'un même élément chimique (ici l'élément Z=86) du nom du plus stable d'entre eux, le radon.
Détermination de la masse atomique
Dans un premier temps, les physiciens pensèrent que l'émanation était une sorte de vapeur de thorium ou de radium, et en 1901 Rutherford voulut vérifier ou exclure cette possibilité en mesurant son poids atomique. Il construisit un eongue chambre d'ionisation cylindrique qu'un capt pouvait séparer en deux parties. Le clapet était d'abord fermé, la partie gauche remplie d'émanation jusqu'à stabilisation de l'ionisation mesurée par un électromètre. Rutheford utilisa l'émanation du radium, dont la durée de vie de 4 jours remdait la mesure plus simple que celle du thorium de durée de vie 1 mn.

Montage de Rutherford pour déterminer la masse atomique du radon
Puis le clapet était ouvert, laissant l'émanation (et l'air) se répandre dans la deuxième moitié, et l'ionisation des deux chambres était mesurée en parallèle. Quand elles se stabilisaient à la même valeur, on estimait que l'émanation était répartie de manère homogène. Le temps nécessaire pour arriver à cette homogénéisation dépendait, selon la théorie cinétique des gaz, de la masse moléculaire, que Rutherford et Brooks estimèrent entre 40 at 100. Marie Curie avait estimé en 1899 que la masse atomique du radium était supérieure à 140 (Sur le poids atomique du métal dans le chlorure de baryum radifère Comptes Rendus Ac Sc, 129: 760-762:1899). Rutherford rejeta alors l'idée que l'émanation était une vapeur métallique. En fait, l'expérience était sujette à nombre d'erreurs et d'incertudes, et la masse atomique du radium est de 226 et celle de l'émanation du radium est de 222. Ironiquement, une meilleure expérience aurait donc conduit Rutherford à l'erreur.
Durée de vie
Que l'activité de l'émanation du thorium diminue de moitié toutes les minutes, et que celle du radium diminue de moitié tous les 4 jours ne pouvait s'expliquer que si le phénomène était intrinsèquement probabiliste, et que la probabilité qu'un atome d'émanation du thorium disparaisse au cours d'une minute était constante, toujours égale à 50%. Autrement dit, l'atome d'émanation ne vieillissait pas et il pouvait disparaître à tout moment (et certainement pas au bout d'une minute comme on l'imagine parfois).
Ce phénomène était totalement nouveau en physique et ne trouva d'explication qu'avec l'aavènement de la mécanique quantique. Mais il devint facile à observer par tous à partir de 1903 quand Crookes diffusa son spinthariscope: une aiguille porteuse d'une (très petite) quantité de bromure de radium émetteur de rayons alphas, un écran de sulfure de zinc provoquant une étincelle à chaque impact d'une particule alpha et un oculaire permettant de mieux voir l'étincelle. En regardant dans le spinthariscope, on voyait des étincelles s'allumer de manière aléatoire sur le fond sombre de l'écran: Crookes parlait d'une "mer lumineuse turbulente".


tous les éléments radioactifs se comportent de cette façon: chacun de leur atomes a une probabilité définie et constante de disparaître pendant chaque seconde (ou chaque minute, ou chaque million d'années selon l'activité de l'atome en question). La durée au bout de laquelle la moitié des atomes radioactifs d'un échantillon a disparu (et donc l'activité de l'échantillon a diminué de moitié) est la demi-vie t1/2 de l'élément en question. Elle est reliée simplement à la période de décroissance exponentielle τ qui intervient dans l'équation A(t) = A(0) exp{-t/τ) qui donne l'activité au temps t connaissance l'activité au temps t=0.
t½ = τln 2
Les demi-vies des éléments radioactifs sont extrêmement variables et bien sûr, pour des durées extrêmement brèves ou extrêmement longues, il n'est pas possible d'observer directement la lois de décroissance exponentielle. Mais la demi-vie se calcule simplement en mesurant l'activité par unité de masse de l'élément.
Frederick Soddy
Frederick Soddy (1877-1956) fut nommé en 1900 démonstrateur de chimie à McGill, où il resta 2 ans → collaboration très fructueuse avec Rutherford, d’abord sur l’émanation, puis sur les transmutations radioactives. Il retourna à Londres en 1903, où il collaboration avec William Ramsay sur les gaz inertes — dont le radon Nommé professeur à Glasgow en 1904, il y démêla l’écheveau des filiations radioactives (montrant que le radium provenait de l’uranium) Il y conçut également la notion d’isotope Professeur à Aberdeen en 1914, puis à Oxford en 1919, il reçut le prix Nobel de chimie en 1921 pour ses travaux sur les isotopes Il proposa ensuite — sans succès —une réforme de l’économie (anticipant J.M. Keynes).

Transmutations
Soddy : «C’est une transmutation! Le thorium se désintègre et se transmute en argon.»
Rutherford : «Pour l'amour du ciel, Soddy, ne prononcez pas ce mot. On va vouloir nos têtes en nous traitant d'alchimistes»
NB : pas de l’argon mais du radon. Rutherford et Soddy ne comprenne pas tout de suite qu’une transmutation alpha donne – toujours ! – l’élément situé deux rangs avant dans le tableau périodique. L’argon (Z=18) se trouve très loin du thorium. Mais Rutherford et Soddy l’avaient simplement identifié comme un gaz inerte ≠ plus lourd que l’hélium ou le néon

Thorium X
La découverte des émanations et de la part importante qu'elles jouaient dans la radioactivité du radium et du thorium avait conduit en 1900 Crookes à préparer de l'uranium chimiquement pur, et à observer que sa radioactivité était quasi-nulle. La radioactivité attribuée à l'uranium devait donc résulter d'une impureté inconnue, baptisée faute de mieux "uranium X". Becquerel confirma ce résultat en 1901, mais il remarqua que la radioactivité de l'uranium pur réapparaissait progressivement, ce qui le laissa perplexe car cela semblait exclure l'idée d'une impureté. Après les travaux de Rutherford et Soddy, la question de l'uranium X fut reprise, et il s'avéra qu'il y avait en fait un uranium X1 et un uranium X2, puis un uranium Z, puis d'autres éléments radioactifs encore…
De son côté, Rutherford voulut vérifier si le thorium était bien à l’origine de son émanation. Au cours du printemps 1901, Soddy isola donc du thorium très pur en faisant agir de l'ammoniac sur du nitrate de thorium, précipitant le thorium. Mais le précipité de thorium se révéla inactif, tandis que ce restait dans la solution était radioactif, et produisait de l'émanation! Ils baptisèrent thorium X cet élément actif, qui pourtant n'était chimiquement pas du thorium.
La radioactivité de ce thorium X diminuait au cours du temps avec une demi-vie de 4 jours environ, et il produisait en même temps de l'émanation du thorium.
Le thorium naturel contiendrait-il une impureté seule responsable de la radioactivité et de l'émanation (comme la pechblende contenait du radium et du polonium)? En fait non car, laissé à lui-même le précipité de thorium inactif retrouvait progressivement sa radioactivité initiale en trois semaines. Le thorium régénérait spontanément du thorium X, qui n'était donc pas une impureté mais un élément inévitablement fabriqué par le thorium.

Décroissance de la radioactivité du thorium X et reprise d’activité du thorium purifié (Rutherford & Soddy 1902).
Rutherford et Soddy finirent par admettre que le thorium fabriquait du thorium X, un élément chimique différent, et disparaissait sans doute dans l'opération, que ce thorium X fabriquait de l'émanation, là aussi un élément chimique différent et disparaissait dans l'opération (demi-vie de 3.6 jours), et que l'émanation disparaissait aussi (demi-vie de 56 s) en fabriquant un autre élément radioactif encore. Il se révéla ensuite qu'il y avait là un enchaînement rapide d'un élément très instable avec une demi-vie de 0.15 s (provisoirement nommé thorium A) suivi d'un élément avec une demi-vie de ~10 h (thorium B). Le tableau se compliqua ensuite, mais Rutherford et Soddy rassemblèrent en 1903 leurs observations et leurs conclusions dans deux articles intitulés Cause et nature de la radioactivité, dans lesquels ils posaient que:
☞ La radioactivité correspond à une transmutation (ou désintégration, terme moins connoté avec l'alchimie) d'un élément chimique en un autre.
☞ «La désintégration de l'atome et l'expulsion de particules lourdes chargées (…) conduisent à un nouveau système, plus léger, dont les propriétés physiques et chimiques sont totalement différentes de celles de l'élément originel.»
☞ «La radioactivité de chacune de ces substances est liée, non pas à la transformation par laquelle elle a été produite, mais à la transformation au cours de laquelle elle produit à son tour le nouveau type suivant.»
☞ L’émission d’une particule alpha ou bêta n’accompagne pas la transformation, elle est la transformation.
☞ «Parmi tous les éléments, les radioéléments sont ceux qui possèdent le poids atomique le plus élevé. C'est de fait leur unique caractéristique chimique commune.»
☞ Les éléments lourds comme l’uranium, le thorium, le polonium et le radium, étaient naturellement instables et ils se transmutaient continuellement en formant des éléments radioactifs plus légers jusqu’au produit final, qui était le plomb comme il apparut plus tard.
L'accueil de la communauté des physiciens fut d'abord très réservé devant l'affirmation audacieuse d'une impermanence des atomes. Pierre Curie, rédigeant en 1904 un état des lieux de la radioactivité rassemblant tous les travaux sur la question à travers le monde, ne mentionne pas cette idée. Mais l'idée de familles radioactives, rassemblant des éléments qui se transmutaient en cascade les uns dans les autres, fut finalement acceptée assez rapidement.
Mésothoriums, radiothorium, et thoriums A, B, C, D
Rutherford et ses collègues esquissèrent 3 familles radioactives
- celle de l’uranium
- celle du thorium
- celle du radium

Otto Hahn découvrit chez Ramsay en 1905 qu’un radiothorium s’intercalait entre le thorium et le thorium X. Il vint travailler avec Rutherford, puis découvrit en 1906-1907 à Berlin qu’un mésothorium I et un mésothorium II s’intercalaient à leur tour entre thorium et radiothorium.
De son côté, l’émanation du thorium rendait radioactifs les éléments qu’elle touchait. L'émanation déposait un élément radioactif, le thorium A très instable qui donnait du thorium B, qui donnait à son tour du thorium C, puis du thorium D, qui lui était enfin stable. S'intercalèrent ensuite un thorium C' et un thorium C". Cette nomenclature n'impliquait aucunement, dans l'esprit des physiciens et des chimistes que ces éléments soient du thorium, simplement qu'ils étaient obtenus en cascade à partir du thorium. Cela n'interdisait pas au demeurant que certains puissent être chimiquement du thorium (c'est d'ailleurs le cas du radiothorium). Il apparut aussi que les chaînes de transmutations radioactives pouvaient se ramifier en fin de chaîne, d'où les C' et C". On sait désormais que certains corps radioactifs peuvent aussi bien subir une transmutation alpha qu'une transmutation bêta (avec des probabilités différentes), d'où branchement. Mais en général dans ce cas, la transmutation alpha est suivie d'une bêta, et la bêta d'une alpha, aboutissant au même élément final.
Une fois déchiffrée, la chaîne du thorium se révéla être:
| Nom | Thorium | Mesothorium 1 | Mesothorium 2 | Radiothorium | Thorium X | Thoron | Thorium A | Thorium B | Thorium C | Thorium C’ | Thorium C’’ | Thorium D |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identité | Th232 | Ra 228 | Ac 228 | Th 228 | Ra 224 | Rn220 | Po 216 | Pb 212 | Bi 212 | Po 212 | Tl 208 | Pb 208 |
| Demi-vie | 1.4*1010 ans | 5.75 ans | 6.1 h | 1.9 année | 3.6 jours | 55.6 s | 0.15 s | 10.6 h | 60.5 mn | 300 ns | 3.05 mn | stable |
Chaque élément d’une chaîne fabriquait à un rythme constant l’élément suivant, et disparaissait ce faisant, avec une demi-vie qui lui était propre et ne dépendait pas des conditions physiques ni chimiques. Les demi-vies sont extrêmement variables d'un élément à un autre de la chaîne, et certaine sosnt trop brève spour que l'élément soit observable: sa brève existence est reconstituée à partir de sa désintégration 'observation dun bêta par exemple). Tous les éléments de la chaîne partant du thorium (de masse atomique 232) ont une masse atomique de la forme 4n: 232 → 228 → 224 → 220 → 216 → 212 → 208. Ce fut un élément important pour Soddy dans son élaboration de la notion d'isotope.

La situation se révéla plus compliquée encore pour le radium: à l'émanation du radium succédaient des dépôts solides baptisés radiums A, B, C, D (avant que s’intercalent ensuite des radiums C’ ou C’’), E, F et G, qui était stable (non radioactif).
| Nom | Radium | Radon | Radium A | Radium B | Radium C | Radium C’ | Radium C’’ | Radium D | Radium E | Radium F | Radium E" | Radium G |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identité | Ra 226 | Rn 222 | Po 218 | Pb 214 | Bi 214 | Po 214 | Tl 210 | Pb 210 | Bi 210 | Po 210 | Tl 206 | Pb 206 |
| Demi-vie | 1602 ans | 3.8 jours | 3.1 mn | 26.8 mn | 19.9 mn | 164 µs | 1.3 mn | 22.2 ans | 5.0 jours | 138 jours | 4.2 mn | stable |
Pour l’uranium, l'uranium X s'était révélé à l'origine du radium, ce qui raccorda les deux chaînes:

Mais ce n'était pas si simple, et la situation fut compliquée par les isoméries du protactinium 234 identifié diversement comme "brévium", "uranium X2" et "uranium Z" (Hahn 1921). La recherche du prédécesseur direct de l'uranium fut ainsi délicate et son découvreur, Otto Hahn, eut beaucoup de mal à abandonner le nom qu'il lui avait donné, l'ionium.
| Nom | Uranium 1 | Uranium X1 | Brévium | Uranium X2 | Uranium Z | Uranium 2 | Ionium | Radium |
|---|---|---|---|---|---|---|---|---|
| Identité | U 238 | Th 234 | Pa 234m | Pa 234m | Pa 234 | U 234 | Th 230 | Ra 226 |
| Demi-vie | 4.5*109 ans | 24 jours | 1.17 mn | 1.17 mn | 6.7 h | 245 500 ans | 7538 ans | 1602 ans |
L’uranium 238 était donc à l'origine d'une chaîne analogue à celle du thorium (la chaîne 4n+2) , chaîne qui passait par le radium 226 des Curie, et se terminait au plomb 206:


L’actinium 227 était lui aussi à l’origine d’un chaîne (la chaîne 4n+3) dont on découvrit plus tard qu'elle partait en réalité de l’uranium 235 (découvert par Arthur Dempster en 1935, et initialement appelé actino-uranium).
| Nom | Actino-uranium | Uranium Y | Actinium | Radioactinium | Actinium K | Actinium X | Actinon | Actinium A | Actinium B | Actinium C | Actinium C' | Actinium C’’ | Actinium D |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identité | U 235 | Th 231 | Ac 227 | Th 227 | Fr 223 | Ra 223 | Rn 219 | Po 215 | Pb 211 | Bi 211 | Po 211 | Tl 207 | Pb 207 |
| Demi-vie | 7.04*108 ans | 25.5 h | 21.8 ans | 18.7 jours | 22 mn | 11.4 jours | 3.96 s | 1.8 ms | 36 mn | 2.14 mn | 0.52 s | 4.8 mn | stable |
Les trois isotopes stables du plomb, le plomb 206 (24% du plomb naturel), le plomb 207 (22%) et le plomb 208 (54%), correspondent aux trois terminaisons des chaînes 4n+2, 4n+3 et 4n.
On peut naturellement se demander ce qu'il en est de la chaîne 4n+1. Elle ne fut découverte que bien plus tard après la découverte du neptunium 237, car seuls les deux derniers éléments sont naurellement présents sur Terre (bismuth 209 quasi stable et tellure 205).
☞ Premier indice de l’existence d’isotopes : l’uranium donne radium, radon, polonium et plomb, le thorium donne aussi radium, radon, polonium et plomb, mais il ne s’agit visiblement pas des mêmes puisque leurs périodes radioactives sont différentes. Il existe donc au moins deux variétés de chacun de ces éléments. Mais il a fallu du temps pour identifier chimiquement les éléments de chacune des chaînes.
Énergie
En 1904, Rutherford et H.T. Barnes mesurèrent l’énergie dégagée par les transmutations. Pour cela ils placèrent une petite quantité de radium (ou d'émanation du radium) dans un petit tube inséré dans le récipient de droite du montage. Un récipient identique contenait à la place une résistance électrique R connue, et les deux récipients étaient connectés à un manomètre mesurant la différence de pression entre les deux récipients. Un dégagement de chaleur dans l'un ou l'autre des récipients conduisait à une augmentation de pression et une dilatation de l'air. En réglant l'intensité I du courant pour que le manomètre indique la même pression, la chaleur libérée par la résistance (effet Joule: P=RI2) égalait la chaleur libérée par le corps radioactif.

Appareil de mesure de l'énergie dégagée par la radioactivité
Rutherford et Barnes mesurèrent une chaleur de 110 calories par heure et par gramme de radium (en équilibre avec ses produits de désintégration. Ils confirmaient ainsi les résultats de Pierre Curie et Laborde qui avaient mesuré en 1903 que la radium libérait 100 calories par gramme et par heure. Rutherford et Barnes observèrent que 70% de cette énergie était due à l'émanation du radium (radon 222) en notant que si le radium était débarassé de l'émanation, la chaleur libérée était beaucoup plus faible mais augmentait exponentiellement avec le temps, tandis que la chaleur libérée par l'émanation diminuait exponentiellement, la somme des deux étant constante. La chaleur libérée suivait exactement la même loi que l'ionisation, confirmant que l'énergie libérée provenait bien de la désintégration radioactive (Rutherford & Barnes Heating effect of the radium emanation Phil. Mag., Ser. 6, 7: 202-219:1904).
Cette quantité d'énergie importante, 104 à 105 fois supérieure à celle d'une réaction chimique, posait le problème de son origine. Qu'elle soit interne à l'atome radioactif semblait violer la loi de conservation de l'énergie. Reprenant la suggestion de Marie Curie, Pierre Curie pensait que , «chaque atome d’un corps radioactif fonctionne comme une source constante d’énergie» grâce à la présence de «centres de condensation d’énergie situées entre les molécules». Cela signifiait en pratique que les atomes radioactifs captaient une énergie diffuse dans l’espace, telles de petites antennes. Kelvin comme Perrin partageaient cette idée, qui ne posait pas de problème quant à la conservation de l'énergie. Si l’énergie du rayonnement radioactif ne venait pas de l’atome lui-même, mais était captée dans son environnement, on pouvait penser qu’elle serait plus difficile à capter au fond d’un puits qu’à l’air libre, d’où l’expérience de Elster et Geitel en 1899 pour mesurer la radioactivité dans un puits de mine.
Rutherford jugeait au contraire que la source d’énergie des atomes radioactifs était interne aux atomes (il parlait d'énergie "latente") parce qu'elle résultait manifestement de leurs transmutations. Il y voyait en 1904 un grand réservoir d'énergie: «If it were ever possible to control at will the rate of disintegration of radioelements, an enormous amount of energy could be obtained from a small amount of matter». Cette suggestion fut reprise par les auteurs de science-fiction (H.G. Wells en particulier dans The world set free et traduit en français sous le titre La destruction libératrice), bien avant qu'une façon d'accéder à cette énergie soit envisagée (en 1932 Rutherford jugeait encore que cette énergie resterait inaccessible). Rutherford suggéra en 1904 qu’une telle source d'énergie pourrait expliquer la température très élevée au centre de la Terre, ainsi que l'énergie rayonnée par le Soleil (Kelvin et Helmholtz avaient proposé comme source d’énergie pour le Soleil un mécanisme de contraction gravitationnelle, ce qui imposait un âge < 30 millions d’années en contradiction avec les données de la géologie sur la durée nécessaire à l'érosion pour aplanir une chaîne de montagne, et avec la paléontologie).
Quand Einstein introduisit la relativité restreinte en 1905, il apporta en particulier l'équivalence de la masse et de l'énergie(la célébrissime équationE = mc2) ⇒ 1 gramme de matière équivalant à 1014 J, une variation (indétectable) de 1 millionième de la masse d’un corps radioactif suffisait à expliquer l’origine de l’énergie rayonnée, alors que la combustion chimique de 1 g pétrole ne libère que 4x104 J. Dans son discours de réception du prix Nobel (rédigé en fait en 1905), Pierre Curie évoque lui aussi cette énergie inépuisable des atomes.
Âge de la Terre
Le chimiste Bertram Boltwood (1870-1927) s'intéressa à partir de 1904 aux relations entre les différents corps radioactifs (ce qu’on nomme aujourd’hui les chaînes de désintégration, comme celle qui fait passer de l’uranium au radium pour aboutir au plomb). Il montra que le radium est un produit de déintégration de l’uranium (car le rapport Ra/U est identique dans tous les minerais étudiés). En mesurant les teneurs en plomb et en hélium (qu’il pensait être les produits finals des chaînes de désintégration de l’uranium et du thorium) de différents minerais, il montra que les minerais des couches géologiques les plus anciennes avaient plus de plomb, et il les avait daté de 250 millions à plus de un milliard d’années en 1907 (535 millions d’années pour un minerai d’urainite américain, 2.2 milliards années pour une thorianite de Ceylan). Il est ainsi le fondateur de la datation par radioéléments

Exemple de calcul (approximatif): les iosotopes 235 et 238 de l'uranium sont présents sur Terre dans le rapport 1:140. L'uranium 235 a une demi-vie de 710 millions d'années,celle de l'uranium 238 est beaucoup plus longue, de 4.5 milliards d'années. Si on suppose que les abondances étaient égales lors de la formation de l'uranium, et comme 140~27, ce moment remonte à 7 demi-vies de l'uranium 235, soit à peu près 5 milliards d'années. En fait, il faut tenir compte d'une part de la transmutation de l'uranium 238 (→ allonge sensiblement l'âge), et d'autre part la proportion initiale n'est pas 1:1 mais 1.65:1 si l'uranium est formé lors l'explosion d'une supernova car les noyaux plus légers sont plus faciles à synthétiser que les noyaux plus lourds (→ diminue l'âge calculé) → âge calculé de la supernova de 6.6 milliards d'années, ce qui est cohérent avec les modèles actuels de formation du système solaire qui lui attribuent un âge de 4.6 milliards d'années, la supernova ayant produit les éléments lourds (comme le carbone ou l'oxygène, les "métaux" dans le vocabulaire des astrophysiciens) devant nécessairement être antérieure.
Retour aux alphas
Rutherford revint ensuite sur une question qui lui tenait à coeur: la nature des rayons alphas. Il avait tenté de mesurer en 1903 les déviations des alphas dans un champ électrique, puis dans un champ magnétique. Cela s'était révélé beaucoup plus dificille que les pour bêta, ce qui signifiait qu'ils étaient soit beaucoup plus lourds soit beaucoup plus rapides, soit les deux. Rutherford avait estimé un rapport masse/charge électrique de l'ordre de celui de l'ion H+, mais avec de grandes incertitudes.
Il était parvenu à dévier es rayons alpha par un très fort champ électrique ou magnétique → donc particules chargées. Sens de la déviation → charge positive. Faible amplitude de la déviation → particules beaucoup plus lourdes qu’un électron → probablement des ions. Restait à trouver de quel élément.

Un montage simple (Rutherford 1903)
Déviation d’une charge électrique e: champ électrique E → Force de Coulomb FCoulomb = eE → accélération γ = e/m E orthogonale à la vitesse initiale → déviation θ~ e/m E/V2

Champ magnétique B → Force de Lorentz FLorentz = e VxB → accélération γ = e/m V.B orthogonale à la vitesse → trajectoire circulaire de rayon r = m/e V/B

Comparaison des déviations électrique et magnétique → m/e et V séparément
Il reprit la question en 1906 et il parvint à démontrer avec un montage plus sensible que tous les alphas avaient le même rapport masse/charge électrique, m/e ~ 2* ion hydrogène H+, quelle que soit la source d'alphas utilisée:
- radium
- radium A (218Po)
- radium F (210Po)
- actinium
- thorium
Il s'agissait donc toujours de la même particule mais laquelle? Un rapport m/e ~ 2 pouvait correspondre à plusieurs identités possibles, (n fois la charge et 2n fois la masse de H+). Il n'existait pas d'ion de masse 2 et de charge +1 donc la possibilité la plus simple était un ion de masse 4 et de charge 2, c'est-à-dire l’ion hélium He++ . Et Ramsay avait précisément découvert l'hélium en 1895 dans les minerais d'uranium, et il avait observé en 1903 avec Soddy l'a formation d'hélium par le radium.

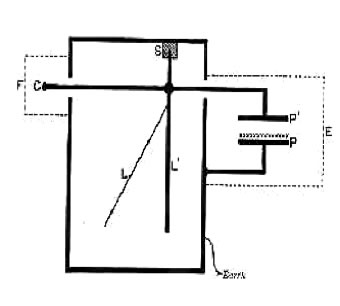
Rutherford pensait donc très probable que les α soient des ions hélium. Mais il demeurait possible que les α soient seulement émis en même temps que des atomes d’hélium. Nommé professeur à Manchester en 1907, il décida de régler la question. Il monta en 1908 avec Thomas Royds l’expérience suivante:
- des α étaient produits par transmutation du radon
- dans une ampoule interne étanche aux atomes d’hélium
- et collectés dans une ampoule externe où le vide était fait Au bout de quelques jours, le contenu de l’ampoule externe manifesta les raies spectrales de l’hélium
Montage:

Prix Nobel
Ernest Rutherford reçut le prix Nobel de chimie en 1908 « pour ses recherches sur la transmutation des éléments et la chimie des substances radioactives ». Ce n’était que le début de sa carrière scientifique! Sa conférence Nobel (11 décembre 1908) porta sur «La nature chimique des particules alpha» Rutherford reçut en 1908 le prix Nobel de Chimie pour ses recherches sur la transmutation des éléments et la chimie des substances radioactives. Le comité Nobel hésita un peu à lui associer Soddy (qui reçut le prix de Chimie en 1921 pour les isotopes).


“I have dealt with many different transformations with various periods of time, but the quickest that I have met was my own transformation in one moment from a physicist to a chemist.” Ernest Rutherford (Nobel banquet 1908)