Alain Bouquet - Le noyau atomique
Attention: ces pages ne sont plus mises à jour car le site a déménagé. Il se trouve désormais à: Pensez à mettre à jour vos signets et bookmarks! |
Champs, Noyaux & particules
Radioactivité
Noyaux, protons et neutrons
- Noyau atomique: Rutherford
- Noyau atomique: Bohr, Soddy et Moseley
- Noyau atomique: Aston et Rutherford
- Neutron: Chadwick
- Neutron: Joliot-Curie
- Neutron: Fermi
Intruments, accélérateurs et détecteurs
Mécanique quantique
- Mécanique ondulatoire
- Formalisme quantique
- Applications
- Théorie quantique des champs
- Électrodynamique quantique
Fission nucléaire
Fusion nucléaire
Particules en tout genre
Le modèle de Bohr

L'acceptation rapide de l'idée d'un noyau atomique à partir de 1914 est en fait due au modèle d'atome de Niels Bohr qui l'employait, et des remarquables expériences d'Henry Moseley qui, s'appuyant sur l'atome de Bohr, établirent l'identité entre numéro atomique d'un élément et charge électrique de son noyau. Après un mémoire sur la vibration des liquides (qui lui fut très utile 30 ans plus tard quand il construisit une théorie des noyaux sous forme de "goutte liquide"), Niels Bohr (1885-1962) avait soutenu en mai 1911 une thèse sur la théorie électronique des métaux, puis obtenu une bourse pour aller à Cambridge travailler au Cavendish avec J.J. Thomson. mais il préféra vite rejoindre Rutherford à Manchester en mars 1912, où il resta jusqu'en août avant de retourner à Copenhague se marier. Inspiré par le modèle de noyau compact portant toute la charge positive proposé par Rutherford, il élabora un modèle dans lequel les électrons orbitent autour de ce noyau. Son premier objectif était de reproduire le spectre de l’hydrogène (les raies des séries de Lyman, Balmer et Paschen).

La question des raies atomiques troublait les physiciens depuis presque un siècle. Leur existence même indiquait que les atomes ne pouvaient émettre de la lumière qu'à certaines fréquences, ou longueurs d'onde, bien précises. Planck en 1900, et surtout Einstein en 1905, avaient introduit l'idée qu'à une lumière de fréquence ν donnée correpondant des particules de lumière, les photons (alors appelés quanta de lumière), chacun porteur d'une énergie hν où la constante de Planck h=6.62*10-34 J*s. Admettant que la lumière était émise par les électrons, Bohr en conclut que ceux-ci ne pouvaient, eux aussi, posséder que des énergies précises et que l'énergie des photons émis ou absorbés devait correspondre à la différence entre deux énergies possibles des électrons.
Bohr s'attaqua à l'atome le plus simple, celui de l'hydrogène. Le spectré de l'hydrogène présentait des raies connues depuis le milieu du 19° siècle, mais le premier élément permettant de comprendre leur origine fut la formule découverte empiriquement par Johann Balmer en 1885: les quatre raies alors connues dans la partie visible du spectre, baptisées Hα, Hβ, Hγ et Hδ à des longueurs d'onde λ=656, 486, 434, et 410nm, sont données avec une grande précision par la formule λ = λ0 m2/(m2-4) avec λ0 = 364 nm et m=3, 4, 5 et 6 (m=7 à 390 nm fut ensuite découverte). En 1888, Johannes Rydberg généralisa cette formule sous la forme λ = λ0 m2n2/4(m2-n2) où n est aussi un nombre entier (mais strictement inférieur à m), la formule de Balmer correspondant à n=2. La formule de Rydberg peut se réécrire 1/λ = 4/λ0[1/n2 - 1/m2], ou encore ν = ν0 [1/n2 - 1/m2].
Ce qui semblait un jeu d'écriture devint crucial quand Theodore Lyman découvrit à partir de 1906 les raies de l'hydrogène dans l'ultraviolet (la série de Lyman) qui correspondaient exactement à la valeur n=1 (et m=2, 3, 4, 5 et 6), puis quand Friedrich Paschen découvrit en 1908 les raies dans l'infrarouge correspondant à n=3 (et m=4, 5, 6, 7 et 8). La série de Brackett (n=4) fut observée en 1922 puis la série de Pfund (n=5) en 1924 dans l'infrarouge lointain.
Bohr pouvait déduire de la formule de Rydberg ν = ν0 [1/n2 - 1/m2] que l'électron de l'atome d'hydrogène avait toujours des énergies quantifiées de la forme E0/n2 et le modèle de Rutherford devait lui permettre de calculer la quantité E0 = hν0 et la confronter aux observations. Une charge électrique -e de masse M en orbite autour d'une autre charge +e à distance r a une énergie potentielle -e2/r et une énergie cinétique MV2/2=e2/2r pour une orbite circulaire, d'où une énergie totale E=-e2/2r (négative, donc état lié).
Restait à comprendre pourquoi le rayon r de l'orbite ne pouvait prendre que des valeurs précises ayant la forme très particulière r = r0n2, ce qui avec E0=e2/2r0 lui donnait les bonnes énergies. Bohr finit par conclure que cela marcherait si le moment cinétique orbital de l'électron L=MrV ne prenait que des valeurs proportionnelles à la constante de Planck (plus exactement la constante de Planck h divisée par 2π, ce qu'on note ħ, et qui se lit h barre). En effet, puisque MV2/2=e2/2r
MrV = nħ ⇒ (MrV)2 = Me2r = (nħ)2 ⇒ r = (ħ2/Me2)n2 ⇒ r0 = ħ2/Me2 = 0.053 nm ou 0.53 Å (rayon de Bohr de l'hydrogène)
et alors
E0 = e2/2r0= Me4/2ħ2 = 13.6 eV
(qui est bien l'énergie correspondant à la fréquence ν0 de la formule de Rydberg)
Le modèle de Bohr, supposant correcte l'hypothèse de Rutherford sur l'existence d'un noyau, permetait de reproduire, sans aucun paramètre libre, le spectre de l'hydrogène. En prime, il permettait de comprendre la taille de l'atome d'hydrogène. Mais il exigeait que
- l’électron ne suive que certaines orbites (celles pour lesquelles L=nħ)
- qu'il ne rayonne pas sur ces orbites
- et qu'il émette en changeant d’orbite un photon de fréquence ν=(E1-E2)/h
et son modèle ne s'appliquait guère aux autres atomes. Bohr publia sa théorie dans trois articles du Philosophical Magazine parus en 1913. Ils lui assurèrent sa gloire, et lui valurent le prix Nobel de physique en 1922. Assistant à l'université de Copenghague, puis brièvement professeur à Manchester en 1914, il devint professeur à Copenhague en 1916, où il fonda en 1920 un Institut de physique théorique par lequel passèrent, pour des séjours longs ou brefs, la quasi-totalité des physiciens qui réalisèrent la théorie quantique, la physique nucléaire et la physique des particules.
Le succès du modèle de Bohr pour les raies de l’hydrogène a convaincu Rutherford (c’est lui qui le dit en tout cas) de la valeur de son modèle de noyau très petit. Mais la structure des atomes de Z plus grand restait obscure, et celle de leurs noyaux encore plus.
Soddy et les isotopes
Frederick Soddy (1877-1956) collabora avec Rutherford à l'Université McGill de Montréal, avant de travailler avec Ramsay à Londres, puis d’être successivement professeur à Glasgow, Aberdeen, et enfin Oxford. Il résolut la question de la position dans le tableau de Mendeleïev de tous les radioéléments détectés dans les minerais d’uranium et de thorium, dont les propriétés chimiques étaient voisines d’éléments connus, ou identiques. Soddy les appela des isotopes occupant la même position dans le tableau et ne différant que par leur masse atomique (et leur radioactivité). Ainsi le radium, le mésothorium, l'actinium X et le thorium X avaient tous 88 électrons autour du noyau central, mais leur masse atomique était respectivement égale à 226, 228, 223 et 224. On les appelle tous aujourd’hui radium. Soddy reçut le prix Nobel de chimie en 1921.
 Frederick Soddy
Frederick Soddy
EN PLEIN BROUILLARD
Rutherford et ses collègues avaient esquissé 3 séries radioactives, celles de l’uranium, du thorium et du radium.

Soddy avait ensuite raccordé la série du radium à celle de l’uranium, et la série de l’actinium s’était ajoutée:
- Uranium I → uranium X1 → uranium X2 → uranium II → ionium → radium → émanation du radium → radium A → radium B → radium C [C1, C2 et C’] → radium D → radium E → radium E’’ → radium F = polonium → radium G
- Thorium → mésothorium I → mésothorium II → radiothorium → thorium X → émanation du thorium → thorium A → thorium B → thorium C → thorium C’ ou thorium C’’ → thorium D
- Actinium → radioactinium → actinium X → émanation de l’actinium → actinium A → actinium B → actinium C → actinium C’ou C’’
Les physiciens et les radiochimistes étaient parfaitement conscients que ces radiums/thoriums/actiniums A, B, C, n'étaient pas, chimiquement parlant, du radium, du thorium ou de l'actinium, la nomenclature ne servait qu'à préciser leur filiation. L'identité chimique de certains de ces corps était connue (par exemple le radium F était le polonium des Curie), mais c'était très difficile pour ceux dont la demi-vie était trop brève pour qu'une analyse chimique normale puisse être accomplie. Pour d'autre, la situation était confuse car leur comportement chimique aurait conduit à les identifier comme du bismuth, par exemple, alors que leur comportement physique, et en particulier leur radioactivité n'avait rie à voir. Il était donc plus prudent de leur conserver leurs noms de radium E ou de thorium C. La situation, fin 1913, était la suivante selon la revue de référence :

on observait les chaînes (la 3° colonne donne la ½ vie de l’élément, la 4° la valence, et la 5° le mode de désintégration alpha et/ou bêta)

Il fallut beaucoup de travaux minutieux de radiochimie, dans de nombreux laboratoires pour identifier chimiquement tous les éléments des chaînes de l'uranium, du thorium puis de l'actinium et s'assurer de leurs enchaînements sans perdre l'étape intermédiaire. Les travaux de Fajans, Hevesy, Russell, Soddy et surtout Hahn et Meitner furent cruciaux. Les séries radioactives connues contenaient près d’une quarantaine d’éléments, tous apparemment situés entre l’uranium et le plomb. Mais de l’uranium (élément 92) au plomb (élément 82), il n’y a que 11 places dans le tableau de Mendeleiev ! D'autant que les éléments 85 et 87 n’étaient pas connus.
Des travaux minutieux de radiochimie établirent l'identité chimique -mais non physique- de plusieurs éléments :
- radiothorium et thorium [Otto Hahn 1905]
- mésothorium I et radium [Otto Hahn et Lise Meitner 1908?]
- mésothorium II et actinium
- radioactinium et thorium
- radium D, radium G et plomb [George de Hevesy 1912]

Otto Hahn (1879-1968) fut le grand maître de la radiochimie. En collaboration parfois étroite, parfois plus distante, avec Lise Meitner (1878-1968), il découvrit en 1905 le radiothorium [Th 228] (1905) qu'il ne put séparer chimiquement du thorium [Th232], puis le mésothorium I [Ra228] et le mésothorium II [Ac228] en 1907, puis le prédécesseur du radium qu'il appela ionium [Th230], en 1907 également. Il devint le directeur du département de radioactivité du Kaiser Wilhelm Institut für Chemie (KWI-C) à sa création en 1912. Les Instituts Kaiser Wilhelm (nommés en l'honneur de l'empereur Guillaume II) avaient été créés pour développer la recherche fondamentale et appliquée dans tous les domaines. Ils furent renommés Instituts Max Planck en 1945.
Hahn découvrit également le protactinium [Pa231] en 1917 avec Lise Meitner (Fajans avait repéré le Pa234, très instable, en 1913 et lui avait donné le nom de brevium, mais la norme est de donner à un élément celui de l'isotope le plus stable). Le grand titre de gloire de Hahn est cependant sa découverte de la fission de l'uranium en 1938 avec Lise Meitner et Fritz Strassmann, qui lui valut le prix Nobel de chimie 1944.

Lise Meitner (1878-1968) fut une des premières femmes à obtenir un doctorat en physique (1906). Elle fut une grande rivale de Marie Curie, puis ensuite d'Irène Curie, en raison de leurs personnalités tranchées. Elle rencontra de nombreuses difficultés dans sa carrière car elle était une femme.
Elle devint directrice du département de physique du KWI-C en 1917. D'origine juive, elle dut s’exiler en Suède en 1938 (quand, après l'Anschluss, sa nationalité autrichienne ne la protégea plus à Berlin) et c'est en exil qu'elle élucida les mystères de la fission avec son neveu Otto Frisch.

Meitner et Hahn dans leur laboratoire au Kaiser Wilhelm Institut
Soddy
Après sa découverte avec Rutherford des transmutations radioactives, Soddy était retourné à Londres en 1903, collaborant avec Ramsay sur les gaz inertes. Professeur à Glasgow en 1904, il s’attacha à améliorer les techniques de séparation chimique des radioéléments. À partir de 1910, il analysa de plus près avec Alexander Fleck les chaînes radioactives et il établit les "règles de déplacement", en 1911 pour les alpha et en 1913 pour les bêta). Professeur à Aberdeen, puis à Oxford après 1919, il n’y créa pas d’école de radiochimie rivalisant avec l’école de radiophysique de Cambridge.
La situation était d’autant plus confuse que les masses atomiques posaient problème :
- alpha = hélium ⇒ perte de 4 unités de masse atomique par émission alpha
- bêta = électron, de masse négligeable ⇒ pas de perte de masse par émission bêta, ni par émission gamma bien sûr
⇒ tous les éléments d’une même série ont des masses variant de 4 en 4 unités
⇒ existence de 4 séries distinctes: uranium, thorium, actinium et ?
La règle de déplacement pour les alphas
Soddy montra en 1911 qu’une transmutation alpha
- diminuait toujours la masse atomique de 4 unités (A → A-4)
- et diminuait toujours de deux rangs la position de l’élément dans le tableau périodique (Z → Z-2)
Le "toujours" est important, parce que cette règle avait été notée pour certaines transmutations alpha, mais elle ne paraissait pas systématique dans la mesure où le produit immédiat de la transmutation n'avait pas toujours été repéré, et encore moins identifié, quand sa durée de vie était brève.
Par exemple, le radium 226 (Z=88) donne de l’émanation (=radon 222, Z=86) , celle-ci donne du radium A (=polonium 218, Z=84), puis du radium B (=plomb 214, Z=82)

F. Soddy « Interpretation of radium », Putnam1909
La règle de déplacement pour les bêtas
A.S. Russell montra en 1913 qu'une transmutation bêta
- ne modifiait pas la masse atomique (A → A)
- mais qu'elle augmentait d’un rang la position de l’élément dans le tableau périodique (Z → Z+1)
Fajans puis Soddy montrèrent que cela était systématique. Par exemple, à la fin de la chaîne précédente, le radium B (plomb 214, Z=82) donne par transmutation bêta du radium C (bismuth 214, Z=83). Mais ce radium C donne du radium D (plomb 210, Z=82) en émettant apparemment un alpha et un bêta. Cela semble violer les deux règles de déplacement à la fois! Problème? Non car il y a deux transmutation successives en réalité: le radium C donne d’abord par transmutation bêta du radium C’ (polonium 214, Z=84) en accord avec la règle, lequel donne ensuite [mais avec la très courte demi-vie de 160 µs] du radium D [plomb 210, Z=82] par transmutation alpha, toujours en accord avec la règle. C'est la détection de tels corps de brève durée de vie qui permit de confirmer le caractère systématique des règles de déplacement, et qui est à l'origine de ces éléments intercalés C' ou C". Bien sûr, il y eut aussi de fausses identifications, et certains noms ont disparu de la liste.
Isotopes
Plusieurs équipes avaient indiqué l’identité chimique, mais non physique, de plusieurs des nombreux éléments des séries radioactives (y compris entre séries différentes). Soddy arriva en décembre 1913 à la conclusion que cela impliquait nécessairement la coexistence de plusieurs éléments dans la même case du tableau périodique. Ces éléments avaient ainsi le même comportement chimique, tout en ayant un comportement radioactif différent (transmutations et demi vies différentes) ainsi que des masses atomiques différentes.
Comme ils se trouvaient au même endroit, en grec iso topos, Soddy les baptisa isotopes.
La décision de baptiser tous les isotopes d'un même élément chimique du nom donné initialement à l'isotope le plus stable mit cependant de nombreuses années (des dizaines parfois)avant de se généraliser et que les anciens noms cessent d'être employés:
Uranium X1 → thorium 234 Thorium → thorium 232 Ionium → thorium 230 Radiothorium → thorium 228 Radioactinium → thorium 227
Les règles de déplacement, associées à la notion d'isotope, permirent de démêler enfin l'écheveau des chaînes radioactives, et Soddy obtint en 1921 le prix Nobel de chimie pour ce travail.

La notion d’isotope n’expliquait pas pourquoi des éléments chimiquement identiques (inséparables) avaient des comportements physiques (masse, durée de vie et transmutation) si différents. Il fallut attendre la mécanique quantique de l'atome, pour l'identité des comportements chimiques, et la mécanique quantique du noyau pour comprendre la différence de masse et de stabilité des isotopes.
Le vieux lion est toujours debout
Telle qu'envisagée par Soddy, la notion d'isotope expliquait l'écheveau des chaînes radioactives, mais elle ne supposait rien quant à l'existence possible d'isotopes des éléments radioactifs (en dehors des trois isotopes du plomb qui terminaient les chaînes connues). C'est le laboratoire Cavendish, en particulier Thomson et ses collègues Wislon et Aston, qui apportèrent la réponse: tous les éléments chimiques pouvaient avoir des isotopes.
En 1913, J.J. Thomson poursuivait au Cavendish des études sur les « rayons canaux », les ions positifs des tubes à décharge partant en sens inverse des rayons cathodiques. Et bien sûr, Thomson tentait de les dévier par des champs électrique et magnétique pour mesurer leur rapport masse/charge électrique. Le résultat n'était pas très surprenant, car il observait bien le rapport attendu pour des ions des éléments qu'il avait placé dans le tube. Il utilisait une plaque photographique pour enregistrer la position de l'impact des ions, et l'image photographique montre bien les traînées obtenues pour le mercure (Hg) dont les ions peuvent être ionisés une fois (Hg+) ou deux fois (Hg++), ou pour le monoxyde de carbone (CO+) et le dioxyde de carbone (CO2+).

Mais le résultat était plus inattendu avec le néon (dont la masse atomique est 20,18). Thomson observa deux taches d'impact, ce qui signifiait que le néon pouvait avoir deux masses légèrement différentes. Il devint clair qu'il y avait deux isotopes: le néon 20 (91% du néon naturel) et le néon 22 (9%) (JJ Thomson Proceedings of the Royal Society A 89, 1-20,1913). L'’isotopie n’était donc pas une propriété limitée aux corps radioactifs, mais une propriété sans doute très générale. Elle apportait en outre une explication aux masses non-entières mesurées pour plusieurs éléments, qui avaient embarassé les chimistes car elles semblaient violer l'idée que toutes les masses atomiques étaiet des multiples de celle de l'hydrogène (autorisant l'idée d'un constituant universel). Les masses non-entières pouvaient être interprétées comme la superposition, en proportions variables, de divers isotopes dont les masses, elles, seraient de snombres entiers.
Francis Aston, élève de Thomson, mit au point en 1919 son permier modèle de spectromètre de masse. Il était beaucoup plus sensible que l'appareillage utilisé par Thomson, etil l'utilisa pour mener une étude systématique. Il montra que la masse atomique de 35.45 du chlore venait de la présence des isotopes 35 (à 75.77%) et 37 (à 24.23%). Il identifia ensuite les isotopes 79 et 81 du brome, et 6 isotopes du krypton. En quelques années, il put ainsi identifier 212 des 287 isotopes naturellement présents. Il améliora considérablement au fil des années la résolution de son spectromètre, et ses mesures de masse très précises (qui lui valurent le prix Nobel de chimie en 1922) montrèrent que les isotopes avaient bien toujours une masse très voisine d’un multiple entier de la masse de l’atome d’hydrogène. En définissant la masse de l’oxygène 16 comme égale à 16 unités, les masses atomiques étaient encore plus proche d’un nombre entier (aujourd’hui on prend le carbone 12 comme base).

Francis William Aston (1877-1945) © Wikipedia
Apparemment, seul le hasard faisait que la plupart des éléments n’avaient qu’un seul isotope abondant, et ainsi une masse atomique presque entière.

Carte des noyaux stables (ou de longue durée de vie). Beaucoup d’isotopes stables sont cependant rares, et ils n’ont pas été identifiés avant les années 1920-1940, comme le deutérium (hydrogène 2), l’azote 15 ou l’oxygène 17 et 18. En 1920, la carte était moins remplie (et elle portait Z en fonction de A et non de N bien sûr)
Henry Moseley
La mesure de la diffusion des particules alpha par les atomes avait permis à Rutherford et à ses collaborateurs de montrer entre 1908 et 1911 que l’essentiel de la masse atomique A d’un atome était rassemblée dans un noyau extrêmement petit et compact, dix mille fois plus petit que l’atome lui-même. Ce noyau possédait une charge positive, repoussant les particules alpha, et les mesures de diffusion indiquaient qu’elle était à peu près égale à la moitié de la masse atomique (multipliée par l’unité de charge électrique). Barkla avait indépendamment démontré en 1911, par la diffusion de rayons X, que le nombre Z d’électrons autour d’un noyau était voisin de A/2. Cela confirmait les résultats de diffusion des alphas : le noyau était entouré d’électrons, dont la charge électrique négative compensait celle du noyau. En 1913, Van den Broek suggéra que cette charge Z était probablement égale au numéro atomique, c’est-à-dire le rang de l’atome quand on le rangeait dans le tableau périodique de Mendéléiev selon sa masse atomique.
En les rangeant strictement par ordre de masse croissante, certains atomes se seraient cependant retrouvés mal placés au vu de leurs propriétés chimiques. Les chimistes avaient par exemple préféré attribuer le numéro atomique 27 au cobalt et le 28 au nickel alors que la masse atomique du cobalt (58.93 car le seul isotope stable du cobalt est le cobalt 59) est supérieure à celle du nickel (58.69, car le nickel naturel est à 68% du nickel 58 et à 26% du nickel 60).
Le retour des rayons X

La nature des rayons X
La découverte de la fluorescence X, ou émission X indirecte, relança l’intérêt des rayons X (pour les physiciens…). Georges Sagnac montra dès 1896 que les métaux frappés par des rayons X en émettent à leur tour. Mais la pénétration de ces rayons secondaire était différente de celle des rayons primaires. cela indiquait une énergie différente pour ces rayons. Avait-on affaire à une fluorescence X ?Sagnac & Curie montrèrent en 1900 qu’une émission d’électrons était associée.
 Charles Barkla (1877-1944, prix Nobel de physique 1917) mena une étude sytématique des ces rayons X:
Charles Barkla (1877-1944, prix Nobel de physique 1917) mena une étude sytématique des ces rayons X:
- Les rayons X diffusés avaient des propriétés identiques aux X incidents, et indépendantes du matériau. Par contre, le nombre d’électrons associés augmentait avec la masse atomique du diffuseur. Pouvait-on en déduire que Z était proportionnel à A ?
- Les rayons X émis avaient au contraire des propriétés indépendantes du rayonnement X incident mais dépendant des caractéristiques du matériau (rayonnement plus «dur» pour les éléments lourds). Mais pas de sa chimie, sa densité, ou sa température. Ceci était analogue à la fluorescence et suggérait que les rayons X étaient des rayonnements électromagnétiques
- Barkla distingua deux types de rayonnement X émis, l’un (→ type A) bien plus pénétrant que l’autre (→ type B). La nomenclature A, B devint ensuite K, L pour laisser de la place si d'autres types étaient ensuite découverts.
Ces études s'inscrivaient dans le vieux débat de savoir si la lumière était une onde ou une particule. Interférences, diffraction et électrodynamique de Maxwell pointaient vers une onde, alors que l'émission thermique (Planck 1900) et l'effet photoélectrique (Einstein 1905) pointaient vers une particule.
Et les rayons X ? Barkla avait montré leur polarisation en 1904. Sommerfeld se demanda en 1912 s’ils pouvaient interférer ou être diffractés. Autre problème alors d’actualité : les cristaux. En 1850, Bravais avait suggéré qu’il s’agissait d’un arrangement régulier d’atomes, mais comment le démontrer? Quelles étaient les structures régulières et leurs tailles?

Max von Laue (1879-1960) eut en février 1912 l’idée de résoudre les 2 problèmes en même temps : diffracter des rayons X sur des cristaux pour en étudier les structures. Cette diffraction des rayons X par les cristaux, observée peu après par ses assistants Friedrich et Knipping, parut si spectaculaire qu'elle lui valut le prix Nobel de physique dès 1914.

Figure de diffraction obtenue par von Laue en 1912 avec un cristal de sulfate de cuivre (CuSO4)
 Cristal de sulfate de cuivre
Cristal de sulfate de cuivre
Diffraction et interférence des rayons X

Onde sur une surface rugueuse :
- réflexion « spéculaire »
- diffusion ~ isotrope
- si la rugosité est un motif répétitif de taille voisine de la longueur d’onde incidente → diffraction (dont l’angle dépend de la longueur d’onde et de la taille du motif)
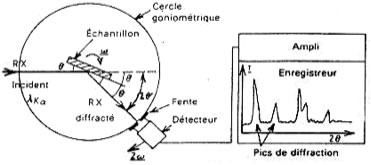
Rayons X et cristaux: toute onde électromagnétique déforme le nuage électronique des atomes et conduit à la réémission d’une onde (de même fréquence) par chaque atome.

Les ondes émises par chacun des atomes d'un cristal interfèrent entre elles, et la régularité du cristal fait qu'il apparaît des angles θ d’émission maximale et minimale dépendant des distances interatomiques d et de la longueur d’onde λ du rayonnement X .

⇒ loi de Bragg nλ= 2d sinθ
William Henry Bragg (1862-1942) fut professeur à Adelaide (Australie) de 1885 à 1908 où il mena des travaux sur la radioactivité à partir de 1904 (sous l’impulsion de Rutherford) puis devint professeur à Leeds en 1909 où il collabora étroitement avec son fils William Lawrence Bragg (1890-1971) . Ils reçurent ensemble le prix Nobel de physique en 1915.
Par application de la loi de Bragg [nλ= 2d sinθ] on peut mesurer la distance interatomique d si la longueur d'onde λ du rayonnement X est connue et, inversement, la longueur d'onde λ si la distance interatomique d est connue. Cela permet donc de faire la spectroscopie des rayons X, et la fluorescence X est déormais un puissant outil d'analyse:.
Henry Moseley
Diplômé d’Eton et d’Oxford, Henry Moseley (1887-1915) devint en septembre 1910 l’un des assistants de Rutherford à Manchester (avec Niels Bohr, Hans Geiger, Georges de Hevesy, James Chadwick, Kazimierz Fajans). Pendant 2 ans, Rutherford lui confia des tâches que Moseley jugeait «ennuyeuses». En juillet 1912, Moseley découvrit les travaux de Laue sur la diffraction des rayons X, et il parvint (en décembre) à convaincre Rutherford d’équiper le laboratoire de coûteuses sources de rayons X et des instruments nécessaires. En février 1913, Henry Moseley et Charles Galton Darwin publièrent un article dans Nature dans lequel ils retrouvaient les résultats que les Bragg venaient d'obtenir.

Henry Moseley en 1910 au Trinity College d’Oxford
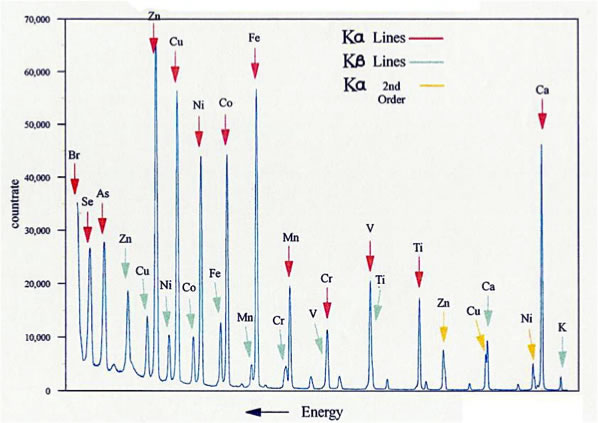
En juillet 1913, Moseley publia un article présentant ses résultats avec les spectres de fluorescence X du platine. Sa méthode était d'effectuer la spectroscopie des rayons X par diffraction : des rayons X primaires émis par une source, bombardaient la cible que Moseley voulait étudier, le platine par exemple. Cette cible réémettait des rayons X secondaires dont la longuer d'onde était caractéristique de la cible (fluorescence X). Ces rayons X secondaires étaient ensuite diffractés par un cristal (connu !) et arrivaient sur un plaque photographique qui les enregistrait. L’angle de diffraction donnait la fréquence des rayons X émis par la cible.

Moseley pouvait ainsi étudier le spectre des rayons X émis par les atomes qu'il plaçait dans la cible. En octobre 1913, Moseley obtint les raies Kα and Kβ du cuivre, du nickel, du cobalt, du fer, du manganèse, du chrome, du vanadium, du titane et du calcium. Les raies se décalaient légèrement d'un élément à l'élement suivant du tableau de Mendeleiev. Voici ce qu’il obtint pour les raies Kα et Kβ des les éléments 20 à 29, du calcium au cuivre:
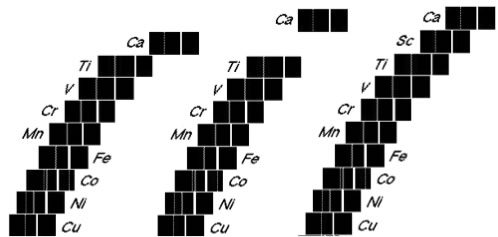
Manifestement, il y avait un trou entre calcium et titane, le scandium, que Moseley examina ensuite et qui s’intercala bien à l’emplacement attendu. IL y avait une bonne corrélation entre la fréquence d'une raie et la masse atomique, mais une corrélation meilleure entre la fréquence et le numéro atomique: la fréquence variait plus régulièrement du calcium au scandium et au titane en suivant la suite 20, 21, 22 des numéros que la suite 40, 45, 48 des masses. En fait la corrélation était encore meilleure avec le carré du numéro atomique.

Ce n'était pas totalement inattendu: le modèle de Bohr, précisément élaboré à Manchester quelques mois plus tôt prédisait que l'énergie des électrons dans un atome (et donc l'énergie des photons émis, qu'ils soient dans le domaine visible, ultraviolet ou X) variait comme le carré de la charge électrique du noyau. La formule de Bohr pour l'hydrogène E0 = Me4/2ħ2 devenait E0 = e2/2r0= MZ2e4/2ħ2 pour une charge Ze. La raie Kα, dans la notation de Barkla (K,L,M,N) modifiée par Mannes Siegbahn (Kα, Kβ…), est l’équivalent pour un noyau plus lourd de la raie Lyman α de l’hydrogène. Elle se trouve dans le domaine des rayons X plutôt que l'ultraviolet comme la raie Lyman α tout simplement parce que l'énergie de l'électron, et donc celle des photons émis, est multipliée par Z2, qui peut vite devenir grand (pour Z~30 on passe des électrons-volts du domaine visible aux kilo-électron-volts du domaine X).
 Niveaux d'énergie de l'atome de cuivre
Niveaux d'énergie de l'atome de cuivre
En réalité, le modèle de Bohr ne s'applique pas très bien aux atomes plus lourds que l'hydrogène parce qu'ils ont plusieurs électrons, qui s'affectent mutuellement et "écrantent" partiellement la charge centrale. En première approximation, l'énergie des électrons varie plutôt proportionnellement non à Z2 mais approximativement comme (Z-a)2, avec la constante empirique a~1, ce qui exactement ce que Moseley observa. Le modèle de Bohr était ainsi validé (provisoirement) de même que le modèle atomique de Rutherford qui était à sa base.
Le résultat le plus important des travaux de Moseley était que le rang d'un élément dans le tableau périodique (numéro atomique) était la charge Z du noyau (en unités de charge élementaire). Le nombre d'électrons orbitant autour de ce noyau était nécessairement égal à Z pour assurer la neutralité électrique de l'atome, et ce nombre d'électrons était responsable des propriétés chimiques de l'atome, ce qui expliquait le lien entre la charge Z du noyau et les propriétés chimiques de l'élement qui lui avaient valu initialement sa place dans le tableau.
- le numéro atomique Z était le paramètre essentiel;
- la masse atomique A avait une signification bien moins fondamentale;
- Z et A étaient deux quantités indépendantes.
Ceci avait plusieurs conséquences majeures:
- on pouvait remplir le tableau sans hésitation puisque chaque case correspondait à un nombre entier, Z, et non un nombre presque entier comme A, et il suffisait de faire la liste des entiers de 1 à 92.
- la spectrocopie X donnait sans ambiguïté la valeur de Z, donc la place de l'élément en question dans le tableau. Moseley plaça ainsi l’argon (Z=18, m=39,9) avant le potassium (Z=19, m=39,1) en meilleur accord avec leurs propriétés chimiques (gaz inerte et métal alcalin) et il confirma que le cobalt était bien le 27° élément et le nickel le 28,° justifiant les inversions que Mendeleiev s'était permis un demi-siècle plus tôt.
- les éléments 43, 61, 72, 75, 85 et 87 devaient exister, et ils furent effectivement découverts de 1923 à 1940.
- mais aucun autre élément ne manquait de l'hydrogène (Z=1) à l'uranium (Z=92)
- il y avait exactement 15 lanthanides (Z=57 à 71), ces "terres rares" aux propriétés chimiques si voisines qu'il était difficile de les séparer chimiquement.
- il n'y avait pas d'indication expérimentale d'éléments au-delà de l'uranum, mais pas d'interdiction non plus.

Le tableau périodique après les travaux de Moseley indiquant en rouge les éléments restant alors à découvrir (avec la date de leur découverte), et en bleu les lanthanides.
À la fin de novembre 1913, Moseley déclina une offre de bourse de la part de Rutherford et il quitta Manchester et retourna à Oxford dans l'espoir d'un poste de professeur. En août 1914, il s’engagea dans l’armée comme lieutenant du génie (dans le corps des transmissions) et il partit au printemps 1915 pour la campagne des Dardanelles, où il fut tué au combat le 10 août 1915.
- « Le plus brillant de tous les hommes avec qui j’ai pu collaborer » Ernest Rutherford
- « Si l’on songe à ce que Moseley aurait pu encore accomplir, sa mort a peut-être été la mort la plus coûteuse de l’histoire des guerres de l’humanité. » Isaac Asimov

Théâtre d'opération des Dardanelles
Van den Broek
Les idées de Moseley furent d'autant mieux accueillies que A. van den Broek avait déjà suggéré (le 20 juillet 1911 dans la revue Nature) que la charge électrique Z du noyau était nettement plus faible que la masse atomique A, d'un facteur 2 à peu près: son argument reposait sur la diffusion des particules alphas par le noyau, car l'angle de diffusion dépend de la charge du noyau et permet donc de l'estimer. L'année suivante, il suggérait qu'à chaque élément chimique devait correspondre une et une seule "charge intra-atomique" et il conclua en 1913 que le numéro atomique et la charge électrique du noyau devait être identiques.
Que la masse atomique A soit plus du double du numéro atomique Z (sauf pour l'hydrogène bien entendu) allait poser un gros problème aux physiciens, jusqu'à la découverte du neutron en 1932, et compliquer leurs modèles du noyau pour parvenir à rendre compte de la différence entre A et Z.